ГОСТ Р 52723-2007
Группа Н00
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕ И КОРМА
Экспресс-метод определения сырьевого состава (молекулярный)
Foodstuffs and feeds. Rapid method of identification of raw composition (molecular)
ОКС 07.100.30 65.120
67.050 67.060
67.100 67.120
67.230
Дата введения 2008-06-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН ООО "Компания "Биоком" при участии ГНУ ВНИИ мясной промышленности им. В.М.Горбатова РАСХН
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 28 мая 2007 г. N 104-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Введение
Настоящий стандарт разработан в соответствии с Федеральным законом "О техническом регулировании" в целях формирования нормативной базы для соблюдения требований законопроектов - специальных технических регламентов о безопасности пищевых продуктов и достоверности информации потребителя о фактическом составе готового продукта.
Настоящий стандарт допускается к применению при контроле кормов, сырья и продуктов питания для выявления фальсификаций сырья, пищевой продукции и детекции несанкционированных примесей в кормах.
Настоящий стандарт распространяется на пищевые продукты, продовольственное сырье растительного, животного происхождения, корма и устанавливает экспресс-метод качественного определения видовой принадлежности содержащихся в них мясных и растительных ингредиентов.
Стандарт предназначен для ускоренной идентификации видоспецифичной ДНК крупного рогатого скота (Bos taurus), свиньи (Sus scrofa), курицы (Gallus gallus), сои (Glycine max), кукурузы (Zea mays), картофеля (Solanum tuberosum) и др. в составе кормов, сырья, полуфабрикатов, готовых продуктов питания методом полимеразной цепной реакции (ПЦР).
Метод оптимален для определения видовой принадлежности растительных и животных компонентов в составе кормов, сырья, пищевых продуктов, в том числе подвергавшихся термической обработке.
1 Область применения
Настоящий стандарт распространяется на экспресс-метод качественного определения видовой принадлежности мясных и растительных ингредиентов, содержащихся в кормах, пищевых продуктах, продовольственном сырье растительного, животного происхождения, в том числе подвергавшихся термической обработке.
Стандарт предназначен для ускоренной идентификации видоспецифичной ДНК крупного рогатого скота (Bos taurus), свиньи (Sus scrofa), курицы (Gallus gallus), сои (Glycine max), кукурузы (Zea mays), картофеля (Solanum tuberosum) и др. в составе кормов, сырья на всех этапах его переработки, транспортирования, хранения, а также полуфабрикатов, готовых продуктов питания методом полимеразной цепной реакции (ПЦР).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 7631-85 Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний
ГОСТ 9792-73 Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб
ГОСТ 10852-86 Семена масличные. Правила приемки и методы отбора проб
ГОСТ 12430-66 Продукция сельскохозяйственная. Методы отбора проб при карантинном досмотре и экспертиз
ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26312.1-84 Крупа. Правила приемки и методы отбора проб
ГОСТ 26313-84 Продукты переработки плодов и овощей. Правила приемки, методы отбора проб
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 27668-88 Мука и отруби. Приемка и методы отбора проб
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и ло соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 полимеразная цепная реакция; ПЦР: Циклический ферментативный процесс, результатом которого является получение многочисленных копий определенного участка молекулы ДНК.
3.2 полимеразная цепная реакция в режиме реального времени: Полимеразная цепная реакция, проводимая по специальной технологии, которая позволяет регистрировать накопление продуктов ПЦР в процессе амплификации.
3.3 амплификация: Образование дополнительных копий хромосомных последовательностей дезоксирибонуклеиновой кислоты ДНК.
3.4 видоспецифичная ДНК: Дезоксирибонуклеиновая кислота, однозначно принадлежащая определенному виду растений или животных.
3.5 биологический реагент: Многокомпонентная смесь химических реактивов, находящихся в определенных соотношениях, применяемая для исследования биологических объектов.
3.6 фальсификационное сырье, продукт: Сырье, продукт, в которых выявлены несоответствия.
3.7 несоответствия: Наличие отклонений от нормативного документа на данный продукт (сырье, ингредиент и т.п.) в показателях качества и безопасности, а также сырьевого и компонентного состава.
4 Оборудование, приборы и наборы реагентов
Допускается применение приборов и оборудования с техническими и средств измерений с метрологическими характеристиками, а также наборов реагентов, по качеству не ниже указанных в настоящем стандарте.
4.1 Спирт этиловый 95%-ный, ректификованный по ГОСТ Р 51652.
4.2 Вода дистиллированная по ГОСТ 6709.
4.3 Дезрастворы, вызывающие деградацию ДНК.
4.4 Дозаторы автоматические одноканальные с переменным объемом: 0,5-10,0 мкл (шаг 0,1 мкл, точность ±10,0%-2,5%); 5,0-50,0 мкл (шаг 0,5 мкл, точность ±5,0%-2,0%); 20,0-200,0 мкл (шаг 1,0 мкл, точность ±2,0%-1,5%); 100-1000 мкл (шаг 5,0 мкл, точность ±1,5%-1,0%).
4.5 Источник напряжения для электрофореза, диапазон регулируемого напряжения - до 300 В.
4.6 Колбы стеклянные мерные конические вместимостью 500-1000 см по ГОСТ 25336.
4.7 Контейнеры для сброса наконечников и использованных пробирок.
4.8 Микрогомогенизаторы дюралюминиевые с защитным оксидным слоем под конические микропробирки вместимостью 1,5 см.
4.9 Микропробирки полипропиленовые конические объемом 1,5 см с крышкой.
4.10 Микроцентрифуга-встряхиватель со скоростью вращения до 2000 об/мин.
4.11 Наконечники для автоматических одноканальных дозаторов в штативах.
4.12 Термостат твердотельный с охлаждением проб для микропробирок вместимостью 0,5 и 1,5 см.
4 13 Персональный компьютер.
4.14 Перчатки резиновые или латексные неопудренные.
4.15 Пинцеты медицинские по ГОСТ 21241.
4.16 Прибор для горизонтального электрофореза.
4.17 Пробирки пластиковые вместимостью 15 см с крышкой.
4.18 Амплификатор (термоциклер) для ПЦР в реальном времени.
4.19 Программируемый термостат (амплификатор) для ПЦР под микропробирки вместимостью 0,2 или 0,5 см со средней скоростью нагрева/охлаждения 0,5-2,5 °С/с и диапазоном задаваемых температур от 20 °С до 99 °С.
4.20 СВЧ-печь объемом не менее 17 л, мощностью не менее 600 Вт.
4.21 Система для документирования гелей с разрешением не ниже 2 млн пикселей в цветном режиме.
4.22 Скальпели хирургические.
4.23 Ступки фарфоровые с пестиками.
4.24 Твердотельный термостат для микропробирок вместимостью 1,5 см, диапазоном рабочих температур от 10 °С до 120 °С.
4.25 УФ-бокс.
4.26 Холодильники бытовые электрические с морозильной камерой, обеспечивающей температуру минус 18 °С по ГОСТ 26678.
4.27 Центрифуга для микропробирок вместимостью 1,5 см со скоростью вращения не менее 16000 об/мин.
4.28 Цилиндры стеклянные мерные лабораторные на 50 см (или 100 см
) и 500 см
по ГОСТ 1770.
4.29 Шпатели одноразовые.
4.30 Штативы для одноканальных автоматических дозаторов на пять мест.
4.31 Штативы под микропробирки вместимостью 0,2; 0,5 и 1,5 см.
4.32 Штативы-контейнеры для хранения образцов в микропробирках вместимостью 1,5 см.
4.33 Набор реагентов для выделения ДНК.
Лизирующий буфер (далее - ЛБ): 5,25 М гуанидинтиоцианата, 50 мМ трис-HCI (рН 6,4), 20 мМ ЭДТАNa
, 1,3% Тритона Х-100.
Отмывочный буфер N 1 (далее - ОБ 1), концентрат: 76% этанола, 0,2 М ацетата Na.
Отмывочный буфер N 2 (далее - ОБ 2), концентрат: 76% этанола, 10 мМ ацетата Na.
Сорбент: 25% частиц SiO размером от 20 до 50 мкм в 50 мМ трис-HCI (рН 6,4).
Буфер элюирующий (далее - ТЕ-буфер): 10 мМ трис-HCI, 1 мМ ЭДТА (рН 8,0).
4.34 Наборы реагентов для амплификации (ПЦР).
4.34.1 Наборы реагентов для амплификации - ПЦР*:
_________________
* Применяют при проведении этапа амплификации по методике, описанной в 7.1.
Пробирки амплификационные с лиофильно высушенной амплификационной смесью состава 80 мМ трис-HCI (рН 8,0), 0,1% Тритона Х-100, 24 мМ (NH)
SO
, 0,5 мМ ЭДТА, дезоксинуклеозидтрифосфатов дАТФ, дТТФ, дГТФ, дСТФ по 500 мМ каждого, Oligo Taq ДНК-полимеразы 0,1 ед/мкл, 0,04% водорастворимого красителя для электрофореза ксиленцианола, 0,16% D-глюкозы, 1,6% инулина, 8% D-маннитола.
ПЦР-растворитель.
Смесь праймеров (олигонуклеотидов) для амплификации определяемых нуклеотидных последовательностей генома крупного рогатого скота:
F5TGAGGACAAATATCATTCTGAGG 3
R5GAGCAAGAATTAGGATAGAGAAG 3
или генома свиньи:
F5GACCTCCCAGCTCCATCAAACATCTCATCATGATGAAA 3
R5GCTGATAGTAGATTTGTGATGACCGTA 3
,
или генома курицы:
F5TCACATCGGACGAGGCCTA 3
R5GGAATGGGGTGAGTATGAGAGTT 3
,
или генома сои:
F5GTGCTACTGACCAGCAAGGCAAACTCAGCA 3
R5GAGGGTTTTGGGGTGCCGTTTTCGTCAAC 3
,
или генома картофеля:
F5GATGGTGCTGTTGCTACTGTTGATGATCC 3
R5 AACATCCATCGTGCAGTACCCCATTTAGC 3
,
или генома кукурузы:
F5 TTCTCGTCGTGTGCCTGGCTCTGTCAG 3
R5 CGTCCATCATCCTCATCTGCTGCTGCTGGC 3
.
Контрольный образец (К+), содержащий ДНК выявляемого вида животного (крупного рогатого скота, свиньи, курицы) или растения (сои, кукурузы, картофеля).
Масло минеральное.
4.34.2 Наборы реагентов для амплификации - ПЦР*:
________________
* Применяют при проведении этапа амплификации по методике, описанной в подразделе 7.2.
Пробирки амплификационные с лиофильно высушенной амплификационной смесью состава по 4.34.1, содержащей праймеры (олигонуклеотиды) для амплификации определяемых нуклеотидных последовательностей генома крупного рогатого скота:
F5TGAGGACAAATATCATTCTGAGG 3
R5 GAGCAAGAATTAGGATAGAGAAG 3
или генома свиньи:
F5GACCTCCCAGCTCCATCAAACATCTCATCATGATGAAA 3
R5GCTGATAGTAGATTTGTGATGACCGTA 3
,
или генома курицы:
F5TCACATCGGACGAGGCCTA 3
R5GGAATGGGGTGAGTATGAGAGTT 3
,
или генома сои:
F5GTGCTACTGACCAGCAAGGCAAACTCAGCA 3
R5GAGGGTTTTGGGGTGCCGTTTTCGTCAAC 3
,
или генома картофеля:
F5GATGGTGCTGTTGCTACTGTTGATGATCC 3
R5AACATCCATCGTGCAGTACCCCATTTAGC 3
,
или генома кукурузы:
F5TTCTCGTCGTGTGCCTGGCTCTGTCAG 3
R5CGTCCATCATCCTCATCTGCTGCTGCTGGC 3
.
ПЦР-растворитель.
Контрольный образец (К+), содержащий ДНК выявляемого вида животного (крупного рогатого скота, свиньи, курицы) или растения (сои, кукурузы, картофеля).
Контрольный образец (далее - К-), не содержащий ДНК выявляемого вида животного (крупного рогатого скота, свиньи, курицы) или растения (сои, кукурузы, картофеля).
Масло минеральное.
4.34.3 Наборы реагентов для ПЦР в реальном времени*:
________________
* Применяют при проведении этапа амплификации по методике, описанной в подразделе 7.3.
Пробирки амплификационные с лиофильно высушенной амплификационной смесью состава 80 мМ трис-НСl (рН 8,0), 0,1% Тритона Х-100, 24 мМ (NH)
SO
, 0,5 мМ ЭДТА, дезоксинуклеозидтрифосфатов дАТФ, дТТФ, дГТФ, дСТФ по 500 мМ каждого, OligoTaq ДНК-полимеразы 0,1 ед/мкл, 0,16% D-глюкозы, 1,6% инулина, 8% D-маннитола для проведения ПЦР в режиме реального времени.
ПЦР-растворитель, содержащий интеркалирующий краситель SYBR Green.
Смесь праймеров (олигонуклеотидов) для амплификации определяемых нуклеотидных последовательностей генома крупного рогатого скота:
F5TGAGGACAAATATCATTCTGAGG 3
R5GAGCAAGAATTAGGATAGAGAAG 3
или генома свиньи:
F5GACCTCCCAGCTCCATCAAACATCTCATCATGATGAAA 3
R5GCTGATAGTAGATTTGTGATGACCGTA 3
,
или генома курицы:
F5TCACATCGGACGAGGCCTA 3
R5GGAATGGGGTGAGTATGAGAGTT 3
,
или генома сои:
F5GTGCTACTGACCAGCAAGGCAAACTCAGCA 3
R5GAGGGTTTTGGGGTGCCGTTTTCGTCAAC 3
,
или генома картофеля:
F5GATGGTGCTGTTGCTACTGTTGATGATCC 3
R5 AACATCCATCGTGCAGTACCCCATTTAGC 3
,
или генома кукурузы:
F5TTCTCGTCGTGTGCCTGGCTCTGTCAG 3
R5CGTCCATCATCCTCATCTGCTGCTGCTGGC 3
.
Контрольный образец (К+), содержащий ДНК выявляемого вида животного (крупного рогатого скота, свиньи, курицы) или растения (сои,
кукурузы, картофеля).
4.34.4 Наборы реагентов для ПЦР в реальном времени*:
________________
* Применяют при проведении этапа амплификации по методике, описанной в подразделе 7.4.
Пробирки амплификационные с лиофильно высушенной амплификационной смесью состава по 4.34.3 для проведения ПЦР в режиме реального времени.
ПЦР-растворитель, содержащий фоновый краситель ROX.
Смесь праймеров (олигонуклеотидов) для амплификации определяемых нуклеотидных последовательностей генома крупного рогатого скота:
F5GCCTTCTCTATCCTAATTCTTGCTCTAATC 3
R5AATAGGTCTGCTACTAGGGCTCAGAATA 3
или генома свиньи:
F5GGCTTTTCCGTCGACAAAGC 3
R5CTGCGAGGGCGGTAATGAT 3
.
Контрольный образец (далее - К+), содержащий ДНК выявляемого вида животного (крупного рогатого скота, свиньи
4.35 Набор реагентов для детекции продуктов амплификации методом электрофореза в агарозном геле:
Буфер для электрофореза (трис-ЭДТА-боратный буфер, сухая смесь).
Агароза для электрофореза.
Бромистый этидий, х.ч.
5 Отбор проб, их транспортирование и хранение, подготовка к анализу
Метод определения сырьевого состава основан на выявлении при помощи ПЦР фрагментов видоспецифичной ДНК, присутствие которых в анализируемом материале однозначно свидетельствует о наличии в нем компонентов тканей растений или животных определенного вида.
5.1 Отбор проб
Отбор проб проводят по национальным стандартам, устанавливающим порядок отбора проб для однородных групп пищевой продукции и кормов - ГОСТ 7631, ГОСТ 9792, ГОСТ 10852, ГОСТ 12430, ГОСТ 13341, ГОСТ 26312.1, ГОСТ 26313, ГОСТ 27668.
Если масса (объем) продукта не установлена в нормативных или технических документах на продукт конкретного вида, то от каждой упаковочной единицы, попавшей в выборку, отбирают:
- не менее 1 шт. - от продукции в потребительской таре в количестве по 5.3.1, 5.3.2, 5.3.3;
- от 50 до 1000 г (см) - от продукции в транспортной таре (кусковой, жидкой, пастообразной, сыпучей и смешанной консистенции).
Для исследования пищевых продуктов животного, растительного происхождения, кормов и продовольственного сырья методом ПЦР отбор образцов для исследования проводят таким образом, чтобы не происходила перекрестная контаминация (загрязнение одного образца другим).
Для этого отбор проб проводят в перчатках, а инструменты, применяемые для отбора и измельчения материала, используют однократно или обрабатывают моющими средствами и стерилизуют в пламени спиртовки или газовой горелки при переходе от пробы к пробе. Отбор проб проводят в чистую стеклянную или пластиковую посуду или одноразовые пластиковые пакеты.
5.2 Транспортирование и хранение
Каждую отобранную пробу маркируют этикетками с указанием наименования продукта, предприятия-изготовителя, номера партии, даты отбора проб, цели исследования, подписей лиц, отбиравших пробу.
Отобранные пробы, предназначенные для исследования вне предприятия-изготовителя, пломбируют и опечатывают печатью организации, отвечающей за контролируемую продукцию, и транспортируют в лабораторию.
Транспортирование образцов осуществляют при температуре, рекомендованной для их хранения. Длительность транспортирования не должна превышать срока годности исследуемого материала.
Образцы исследуемого материала хранят в течение 1 мес (при необходимости повторного анализа) согласно условиям, указанным производителем.
5.3 Подготовка проб к анализу (первичная обработка)
Подготовку проб проводят в условиях ПЦР-лаборатории в зоне первичной обработки материала в соответствии с приложением А (см. А.1).
5.3.1 При исследовании жидких и полужидких материалов (молочных продуктов, соусов, паст, майонезов и пр.) содержимое каждой из доставленных упаковок тщательно перемешивают при помощи одноразового шпателя. Затем отбирают по 1000 мкл содержимого, переносят в одноразовую пластиковую пробирку вместимостью 15 см и тщательно перемешивают, формируя объединенную пробу. В одноразовую микропробирку вместимостью 1,5 см
отбирают 1 см
объединенной пробы, таким образом создавая среднюю пробу, которую маркируют. С целью получения лабораторной пробы при помощи автоматического дозатора отбирают 100-150 мкл материала от средней пробы и помещают его в одноразовую микропробирку вместимостью 1,5 см
, маркируют и используют для выделения ДНК.
5.3.2 При исследовании сухих сыпучих материалов (комбикормов, мясо-костной муки, рыбной муки, сухих кормов для домашних, промысловых и сельскохозяйственных животных, яичного порошка, муки, белкового изолята, пищевых белковых добавок и пр.) от доставленной пробы отбирают не менее 10 навесок (по 5-10 г каждая) в одноразовый полиэтиленовый пакет размером 20x30 см и перемешивают при помощи одноразового шпателя, формируя объединенную пробу (50-100 г). Затем в одноразовую, герметично закрывающуюся пробирку или контейнер отбирают около 10 г объединенной пробы, создавая среднюю пробу, которую маркируют. Если полученная средняя проба не является гомогенной, то перед началом исследования ее помещают в фарфоровую ступку и растирают фарфоровым пестиком до однородного мелкодисперсного, гомогенного состояния. С целью получения лабораторной пробы для выделения ДНК при помощи одноразового шпателя отбирают от гомогенной средней пробы 75-100 мкл материала по насыпному объему, помещают его в одноразовую микропробирку вместимостью 1,5 см, маркируют и используют для выделения ДНК.
5.3.3 При исследовании материалов плотной консистенции (мяса в блоках, мяса механической дообвалки, фаршевых изделий, консервов и консервированных кормов, колбасы, сыра, соевого шрота, фуражной кукурузы и пр.) от поступившего на исследование образца (потребительской упаковки) отбирают не менее 10 навесок (по 5-10 г каждая) и измельчают в фарфоровой ступке. Измельченный материал помещают в одноразовый полиэтиленовый пакет размером 20x30 см, перемешивают при помощи одноразового шпателя, формируя объединенную пробу (50-100 г). Затем в одноразовую, герметично закрывающуюся пробирку или контейнер отбирают около 10 г объединенной пробы, формируя среднюю пробу, которую маркируют. Перед началом исследования пробу измельчают при помощи скальпеля (ножниц), помещают в фарфоровую ступку и растирают фарфоровым пестиком до однородного мелкодисперсного, гомогенного состояния. С целью получения лабораторной пробы для выделения ДНК при помощи одноразового шпателя отбирают от гомогенной средней пробы 100-150 мкл материала по насыпному объему, который помещают в одноразовую микропробирку вместимостью 1,5 см, маркируют и используют для выделения ДНК.
5.3.4 Микропробирки с лабораторными пробами маркируют номером, нанесенным на пробирки (контейнеры) со средними пробами. После получения лабораторных проб пробирки (контейнеры) с оставшимися средними пробами помещают на хранение в течение 1 мес в условиях, указанных производителем исследуемого материала.
6 Выделение ДНК
Сущность методики заключается в том, что вся ДНК, полученная в результате клеточного лизиса, связывается с сорбентом и в таком состоянии проходит стадии очистки, а затем при помощи элюции переводится в раствор.
6.1 Подготовка набора реагентов для выделения ДНК
6.1.1 Содержимое флаконов с ОБ 1 и ОБ 2 переносят в мерные цилиндры и доводят объем до 50 см этиловым спиртом (95%-ный, ректификат). Затем переливают в те же флаконы и перемешивают, переворачивая плотно закрытые флаконы 5-6 раз.
6.1.2 Хранят рабочие растворы ОБ 1 и ОБ 2 в плотно закрытых флаконах при температуре 4 °С в течение 1 года.
6.2 Выделение ДНК сорбентным методом с помощью набора реагентов
6.2.1 В пробирку с подготовленной по 5.3 пробой вносят 400 мкл ЛБ (в случае кристаллизации перед использованием его необходимо подогреть в термостате при температуре от 50 °С до 60 °С и перемешать до полного растворения осадка), гомогенизируют пробу с помощью микрогомогенизатора с целью дополнительного измельчения пробы и наиболее полного смачивания ее ЛБ.
6.2.2 Пробу инкубируют в термостате 30 мин при температуре 65 °С, после чего передают ее на этап выделения ДНК.
6.2.3 Содержимое пробирки перемешивают на микроцентрифуге-встряхивателе. В случае, когда содержимое пробирки затвердело во время инкубации в термостате, в эту же пробирку добавляют 300 мкл (при необходимости до 1000 мкл) ЛБ и тщательно перемешивают на микроцентрифуге-встряхивателе. Затем пробу центрифугируют на высокоскоростной центрифуге 10 мин при 8000 об/мин.
6.2.4 Надосадочную жидкость полностью отбирают с помощью автоматического дозатора, не задевая осадка, и переносят в чистую микропробирку вместимостью 1,5 см, меняя наконечники при переходе от пробы к пробе.
6.2.5 Добавляют к надосадочной жидкости 40 мкл суспензии сорбента. Перед использованием сорбент перемешивают на микроцентрифуге-встряхивателе до получения однородной суспензии. Далее содержимое микропробирки перемешивают на микроцентрифуге-встряхивателе и инкубируют при комнатной температуре 7-10 мин, периодически перемешивая содержимое путем переворачивания плотно закрытой пробирки 2-3 раза. Затем содержимое микропробирки центрифугируют на высокоскоростной центрифуге 10 с при 10000 об/мин. Надосадочную жидкость полностью удаляют при помощи автоматического дозатора.
6.2.6 К осадку добавляют 500 мкл рабочего раствора ОБ1, содержимое пробирки сначала перемешивают на микроцентрифуге-встряхивателе до получения однородной суспензии, а затем центрифугируют 20 с при 2000 об/мин. Надосадочную жидкость удаляют при помощи автоматического дозатора.
6.2.7 К осадку прибавляют 500 мкл рабочего раствора ОБ2, содержимое микропробирки сначала перемешивают на микроцентрифуге-встряхивателе до получения однородной суспензии, а затем центрифугируют 20 с при 2000 об/мин. Надосадочную жидкость удаляют при помощи автоматического дозатора.
6.2.8 Повторяют операции, изложенные в 6.2.6. В последний раз надосадочную жидкость удаляют как можно более полно, не задевая при этом осадка.
6.2.9 Микропробирку открывают, осадок сушат в термостате 5-7 мин при температуре 65 °С. К высушенному осадку добавляют 75 мкл ТЕ-буфера, перемешивают содержимое микропробирки на микроцентрифуге-встряхивателе до получения однородной суспензии и термостатируют 10 мин при температуре 65 °С. (Если суспензия сразу не образовалась, микропробирку помещают в термостат на 2-З мин, после чего вновь перемешивают).
6.2.10 Содержимое микропробирки повторно перемешивают на микроцентрифуге-встряхивателе и центрифугируют на высокоскоростной центрифуге в течение 2 мин при 10000 об/мин.
6.2.11 Надосадочную жидкость (экстракт ДНК) переносят в чистую микропробирку, не задевая при этом осадка, поскольку попадание в нее сорбента может в дальнейшем приводить к ингибированию ПЦР.
6.2.12 Полученный экстракт ДНК передают на этап проведения амплификации и при необходимости хранят при температуре 4 °С в течение 1 мес или при температуре минус 18 °С до 1 года.
6.2.13 В чистую микропробирку отбирают 30-80 мкл ТЕ-буфера и передают на этап проведения амплификации для постановки контролей амплификации.
7 Амплификация фрагментов видоспецифичной ДНК растений и животных
Для выявления фрагментов видоспецифичной ДНК растений и животных используют наборы реагентов для ПЦР, содержащие праймеры, специфичные к ДНК определенного вида растений или животных. При проведении анализа в ПЦР-лаборатории соблюдают меры предосторожности в соответствии с приложением А.
7.1 Качественное определение фрагментов видоспецифичной ДНК растений и животных с использованием наборов реагентов для ПЦР с жидкими праймерами
7.1.1 В штативе размещают и маркируют необходимое число микропробирок с лиофильно высушенной амплификационной смесью по числу анализируемых проб, включая пробирки для положительного и отрицательного контролей. В случае исследования многокомпонентных продуктов число микропробирок на одну пробу, а также число микропробирок для отрицательных и положительных контрольных образцов рассчитывается исходя из того, какое число видов ДНК планируется идентифицировать.
7.1.2 В каждую микропробирку с ПЦР-смесью при помощи автоматического дозатора последовательно вносят 10 мкл ПЦР-растворителя и 5 мкл смеси праймеров для выявления конкретного фрагмента видоспецифичной ДНК того или иного компонента растительного или животного происхождения. Перед использованием смесь праймеров необходимо разморозить в твердотельном термостате с охлаждением при температуре 4 °С, перемешать на микроцентрифуге-встряхивателе 5-10 с, а затем собрать осаждением на дно микропробирки путем центрифугирования на микроцентрифуге-встряхивателе 3-5 с. Последующую работу с праймерами рекомендуется проводить при температуре от 2 °С до 4 °С с использованием твердотельного термостата с охлаждением.
7.1.3 В микропробирку с ПЦР-смесью для отрицательного контрольного образца вносят 5 мкл ТЕ-буфера, подготовленного по 6.2.12. Затем в микропробирки с ПЦР-смесью добавляют по 5 мкл экстракта ДНК каждого из исследуемых образцов, подготовленных по разделу 6. В последнюю очередь в микропробирку с ПЦР-смесью для положительного контрольного образца вносят 5 мкл К+ из используемого набора реагентов для проведения ПЦР.
7.1.4 Содержимое микропробирок растворяют путем легкого перемешивания на микроцентрифуге-встряхивателе. После этого собирают осаждением капли ПЦР-смеси со стенок микропробирок путем центрифугирования на микроцентрифуге-встряхивателе в течение 3-5 с.
7.1.5 Если для проведения амплификации используется амплификатор без нагреваемой крышки, то в каждую микропробирку добавляют по 20-25 мкл (2 капли) минерального масла.
7.1.6 Плотно закрытые микропробирки центрифугируют 5-7 с на микроцентрифуге-встряхивателе при 2000 об/мин и помещают в амплификатор для проведения амплификации по программам, указанным в таблицах 1 и 2. По окончании действия программы пробирки извлекают из амплификатора и в штативе передают на этап детекции продуктов ПЦР.
Таблица 1 - Программа амплификации фрагментов видоспецифичной растительной ДНК (сои, кукурузы, картофеля)
Этап программы | Режим амплификации | Процесс | Число циклов | |
Температура, °С | Время, с | |||
1 | 94 | 180 | Денатурация ДНК | 1 |
2 | 94 | 45 | Денатурация ДНК | 35 |
70 | 30 | Отжиг праймеров | ||
72 | 40 | Синтез ДНК | ||
3 | 72 | 240 | Синтез ДНК | 1 |
Примечание - использование амплификаторов различных моделей может потребовать изменения времени каждого шага и/или изменения температуры отжига праймеров на 1 °С - 2 °С. | ||||
Таблица 2 - Программа амплификации фрагментов видоспецифичной ДНК животных (крупного рогатого скота, свиньи, курицы)
Этап программы | Режим амплификации | Процесс | Число циклов | |
Температура, °С | Время, с | |||
1 | 94 | 180 | Денатурация ДНК | 1 |
2 | 94 | 30 | Денатурация ДНК | 35 |
62 - для крупного рогатого скота, | 30 | Отжиг праймеров | ||
65 - для свиньи, | ||||
66 - для курицы | ||||
72 | 30 | Синтез ДНК | ||
3 | 72 | 180 | Синтез ДНК | 1 |
Примечания - Использование амплификаторов различных моделей может потребовать изменения времени каждого шага и/или изменения температуры отжига праймеров на 1 °С - 2 °С. | ||||
7.2 Качественное определение фрагментов видоспецифичной ДНК растений и животных с использованием наборов реагентов для ПЦР с высушенными праймерами
7.2.1 В зависимости от количества анализируемых проб в штативе размещают и маркируют микропробирки с лиофильно высушенной амплификационной смесью, одну микропробирку с лиофильно высушенной амплификационной смесью К-, одну микропробирку с лиофильно высушенным содержимым К+. В случае исследования многокомпонентных продуктов число микропробирок на одну пробу, а также число микропробирок для отрицательных и положительных контролей рассчитывают исходя из того, какое число видов ДНК планируется идентифицировать.
7.2.2 В каждую микропробирку с ПЦР-смесью при помощи автоматического дозатора вносят 10 мкл ПЦР-растворителя.
7.2.3 В микропробирку К- вносят 10 мкл ТЕ-буфера, подготовленного по 6.2.12. В микропробирки с ПЦР-смесью добавляют по 10 мкл экстракта ДНК каждого из исследуемых образцов, подготовленных по разделу 6. В последнюю очередь в микропробирку К+ вносят 10 мкл ТЕ-буфера, подготовленного по 6.2.12. Содержимое микропробирок растворяют путем легкого перемешивания на микроцентрифуге-встряхивателе. После этого капли ПЦР-смеси собирают осаждением со стенок микропробирок путем центрифугирования на микроцентрифуге-встряхивателе в течение 3-5 с.
7.2.4 Если для проведения амплификации используется амплификатор без нагреваемой крышки, то в каждую микропробирку добавляют по 20-25 мкл (2 капли) минерального масла.
7.2.5 Плотно закрытые микропробирки центрифугируют 5-7 с на микроцентрифуге-встряхивателе при 2000 об/мин и помещают в амплификатор для проведения ПЦР по программам, указанным в таблицах 1 и 2. По окончании действия программы микропробирки извлекают из амплификатора и в штативе передают на этап детекции продуктов ПЦР.
7.3 Качественное определение фрагментов видоспецифичной ДНК растений и животных с использованием наборов реагентов для проведения ПЦР с детекцией в режиме реального времени
7.3.1 В штативе размещают и маркируют необходимое количество микропробирок с лиофильно высушенной амплификационной смесью (для ПЦР в реальном времени) по количеству анализируемых проб, а также микропробирки для К- и К+. В случае исследования многокомпонентных продуктов число микропробирок на одну пробу, а также число микропробирок для К- и К+ рассчитывают исходя из того, какое число видов ДНК планируется идентифицировать.
7.3.2 В каждую микропробирку с ПЦР-смесью (для ПЦР в реальном времени) при помощи автоматического дозатора последовательно вносят и 10 мкл ПЦР-растворителя и 10 мкл смеси праймеров для выявления конкретного фрагмента видоспецифичной ДНК того или иного компонента растительного или животного происхождения. Перед использованием смесь праймеров размораживают в твердотельном термостате с охлаждением при температуре 4 °С, перемешивают на микроцентрифуге-встряхивателе 5-10 с, а затем собирают осаждением на дно микропробирки путем центрифугирования на микроцентрифуге-встряхивателе 3-5 с. Последующую работу с праймерами рекомендуется проводить при температуре от 2 °С до 4 °С с использованием твердотельного термостата с охлаждением.
7.3.3 В микропробирку с ПЦР-смесью для К- вносят 5 мкл ТЕ-буфера, подготовленного по 6.2.12. Затем в микропробирки с ПЦР-смесью (для ПЦР в реальном времени) добавляют по 5 мкл экстракта ДНК каждого из исследуемых образцов, подготовленных по разделу 6. В последнюю очередь в микропробирку с ПЦР-смесью для положительного контрольного образца вносят 5 мкл К+, который входит в состав набора реагентов. Содержимое пробирок растворяют путем легкого перемешивания на микроцентрифуге-встряхивателе. После этого собирают осаждением капли ПЦР-смеси со стенок пробирок путем центрифугирования на микроцентрифуге-встряхивателе в течение 3-5 с.
7.3.4 Если конструкция используемой модели амплификатора требует проведения ПЦР в специальных пробирках-контейнерах, то полученное после растворения и перемешивания содержимое пробирок для амплификации полностью переносят в такие контейнеры.
7.3.5 Плотно закрытые микропробирки центрифугируют 5-7 с на микроцентрифуге-встряхивателе при 2000 об/мин и помещают в амплификатор для проведения амплификации по программам, указанным в таблицах 3 и 4.
Таблица 3 - Программа амплификации (качественного определения) фрагментов видоспецифичной растительной ДНК (сои, кукурузы, картофеля) в режиме реального времени
Этап программы | Режим амплификации | Процесс | Число циклов | |
Температура, °С | Время, с | |||
1 | 94 | 180 | Денатурация ДНК | 1 |
2 | 94 | 30 | Денатурация ДНК | 40 |
70 | 30 | Отжиг праймеров | ||
72 | 30* | Синтез ДНК | ||
* Включение оптики для детекции ПЦР продуктов (в реальном времени): канал для красителей FAM и SYBR Green оптимальная длина волны источника света - 494 нм, оптимальная длина волны для детекции флуоресценции красителя - 518 нм). | ||||
Таблица 4 - Программа амплификации (качественного определения) фрагментов видоспецифичной ДНК животных (крупного рогатого скота, свиньи, курицы) в режиме реального времени
Этап программы | Режим амплификации | Процесс | Число циклов | |
Температура, °С | Время, с | |||
1 | 94 | 180 | Денатурация ДНК | 1 |
2 | 94 | 30 | Денатурация ДНК | 40 |
62 - для крупного рогатого скота, | 30 | Отжиг праймеров | ||
65 - для свиньи, | ||||
66 - для курицы | ||||
72 | 30* | Синтез ДНК | ||
* Включение оптики для детекции ПЦР продуктов (в реальном времени): канал для красителей FAM и SYBR Green оптимальная длина волны источника света - 494 нм, оптимальная длина волны для детекции флуоресценции красителя - 518 нм). | ||||
7.3.6 Проводят детекцию продуктов ПЦР в соответствии с описанием к используемой модели амплификатора (для проведения ПЦР с детекцией в режиме реального времени).
7.4 Качественное определение фрагментов видоспецифичной ДНК животных с использованием наборов реагентов для проведения ПЦР с детекцией в режиме реальном времени
7.4.1 В штативе размещают и маркируют необходимое количество микропробирок с лиофильно высушенной амплификационной смесью (для ПЦР в реальном времени) по количеству анализируемых проб, а также микропробирки для К- и К+. В случае исследования многокомпонентных продуктов число микропробирок на одну пробу, а также число микропробирок для К- и К+ рассчитывается исходя из того, какое количество видов ДНК планируется идентифицировать.
7.4.2 В каждую микропробирку с ПЦР-смесью (для ПЦР в реальном времени) при помощи автоматического дозатора последовательно вносят 10 мкл ПЦР-растворителя, 5 мкл стерильной дистиллированной воды, 5 мкл смеси праймеров и зонда для выявления конкретного фрагмента видоспецифичной ДНК того или иного компонента животного происхождения. Перед использованием смесь праймеров размораживают в твердотельном термостате с охлаждением при температуре 4 °С, перемешивают на микроцентрифуге-встряхивателе 5-10 с, а затем собирают осаждением на дно микропробирки путем центрифугирования на микроцентрифуге-встряхивателе 3-5 с. Последующую работу с праймерами проводят при температуре от 2 °С до 4 °С с использованием твердотельного термостата с охлаждением.
7.4.3 В микропробирку с ПЦР-смесью для отрицательного контрольного образца вносят 5 мкл К-. Затем в микропробирки с ПЦР-смесью (для ПЦР в реальном времени) добавляют по 5 мкл экстракта ДНК каждого из исследуемых образцов, подготовленных по разделу 6. В последнюю очередь в микропробирку с ПЦР-смесью для положительного контрольного образца вносят 5 мкл К+. Содержимое пробирок растворяют путем легкого перемешивания на микроцентрифуге-встряхивателе. После этого собирают осаждением ПЦР-смесь со стенок пробирок путем центрифугирования на микроцентрифуге-встряхивателе в течение 3-5 с.
7.4.4 Если конструкция используемой модели амплификатора требует проведения ПЦР в специальных пробирках-контейнерах, то полученное после растворения и перемешивания содержимое пробирок для амплификации полностью переносят в такие контейнеры.
7.4.5 Плотно закрытые микропробирки центрифугируют 5-7 с на микроцентрифуге-встряхивателе при 2000 об/мин и помещают в амплификатор для проведения ПЦР по программе, указанной в таблице 5.
Таблица 5 - Программа амплификации (качественного определения) фрагментов видоспецифичной ДНК животных (крупного рогатого скота, свиньи) в режиме реального времени
Этап программы | Режим амплификации | Процесс | Число циклов | |
Температура, °С | Время, с | |||
1 | 94 | 180 | Денатурация ДНК | 1 |
2 | 94 | 20 | Денатурация ДНК | 45 |
60 | 60* | Отжиг праймеров | ||
* Включение оптики для детекции ПЦР-продуктов (в реальном времени): канал для красителей FAM. | ||||
7.4 6 Проводят детекцию продуктов ПЦР в соответствии с описанием к используемой модели амплификатора (для проведения ПЦР с детекцией в режиме реального времени).
8 Детекция (обнаружение) продуктов амплификации
8.1 Детекция продуктов амплификации фрагментов видоспецифичной ДНК растений и животных методом электрофореза*
________________
* Детекцию данным методом проводят в случае анализа по 7.1, 7.2.
8.1.1 Детекцию продуктов амплификации проводят при помощи метода электрофореза в агарозном геле, реагенты для проведения которого собраны в специальный набор [18].
8.1.2 Содержимое пакета с надписью "Буфер для электрофореза" полностью переносят в мерную колбу вместимостью 1000 см, растворяют в 600-800 см
дистиллированной воды и доводят объем полученного раствора до 1000 см
дистиллированной водой. Буфер хранят в течение года при комнатной температуре.
8.1.3 Подготовку к работе прибора для горизонтального электрофореза проводят в соответствии с прилагаемым к нему техническим описанием.
8.1.3.1 Размещают прибор на столе и с помощью регулируемых по высоте ножек, ориентируясь по уровням, устанавливают прибор в фиксированное, строго горизонтальное положение.
8.1.3.2 Собирают кювету для заливки геля и устанавливают в нее 1-4 гребенки (в зависимости от количества анализируемых проб) так, чтобы расстояние между зубцами соседних гребенок и одной из стенок кюветы составляло не менее 2 см.
8.1.4 Содержимое одного из пакетов с надписью "Агароза" полностью переносят в коническую термостойкую стеклянную колбу вместимостью 250 см, добавляют 150 см
готового раствора буфера по 8.1.2 (концентрация геля - 1,5%). Суспензию агарозы в колбе доводят до кипения в СВЧ-печи (при средней мощности), периодически помешивая, и продолжают нагревать до совершенно прозрачного состояния (1 мин).
8.1.5 Агарозу охлаждают до температуры от 55 °С до 60 °С, добавляют 10 мкл раствора бромистого этидия, аккуратно перемешивают, а затем наливают в кювету для геля прибора для электрофореза, не допуская образования воздушных пузырьков, так, чтобы толщина геля была не менее 5 мм, а зубцы гребенок были погружены в него не менее чем на 4 мм.
8.1.6 После полного застывания геля (15-20 мин) из геля осторожно извлекают гребенки так, чтобы не повредить образовавшиеся карманы. Кювету с готовым агарозным гелем переносят в электрофорезную камеру прибора.
8.1.7 В камеру для электрофореза заливают готовый раствор буфера для электрофореза так, чтобы жидкость покрывала гелевую пластину слоем 2-3 мм.
8.1.8 Отбирают 10 мкл продуктов ПЦР и осторожно вносят в карман гелевой пластины. При этом следует соблюдать следующий порядок внесения проб: сначала - содержимое пробирки с К-, затем - исследуемые пробы в строго фиксированной последовательности, и в последнюю очередь - содержимое пробирки с К+. Электрофорез проводят при напряжении 100-150 В в течение 20-30 мин, при этом красящий компонент ПЦР-смеси голубого цвета должен продвинуться не менее чем на 1 см от старта.
8.1.9 По окончании электрофореза гель помещают на фильтр трансиллюминатора системы для документирования гелей и проводят учет полученных результатов в ультрафиолетовом свете с длиной волны 312 нм. Регистрацию и документирование полученных результатов путем занесения в базу данных компьютера осуществляют при помощи системы для документирования гелей в соответствии с прилагаемым к ней техническим описанием. Особенности интерпретации результатов качественного определения фрагментов видоспецифичной ДНК приведены в приложении Б (см. Б.1).
8.2 Детекция продуктов амплификации фрагментов видоспецифичной ДНК растений и животных в режиме реального времени*
_______________
* Детекцию данным методом проводят в случае анализа по 7.3, 7.4.
8.2.1 В ходе проведения ПЦР с детекцией продукта в реальном времени амплификатор с помощью программного обеспечения проводит построение кривых флуоресценции накопленных продуктов ПЦР. Данные кривые выражают зависимость флуоресценции от количества проведенных циклов амплификации (рисунок Б.3 приложения Б). При этом прибор автоматически определяет точку начала log-фазы, выраженную в количестве выполненных циклов. Эта точка характеризует исходное количество ДНК-матрицы в реакционной смеси.
8.2.2 Качественное определение видоспецифичной ДНК растений и животных проводят по наличию или отсутствию в реакционной смеси определенного фрагмента (продукта ПЦР), точно характеризующего тот или иной вид растения или животного. Выявление данного продукта происходит за счет встраивания в него интеркалирующего красителя SYBR Green.
8.2.3 Результаты качественного анализа отображаются с помощью программного обеспечения прибора в виде табличных данных. Особенности интерпретации результатов качественного определения фрагментов видоспецифичной ДНК приведены в приложении Б (см. Б.2).
9 Требования безопасности
9.1 При выполнении всех работ необходимо соблюдать требования техники безопасности при работе с химическими реактивами в соответствии с ГОСТ 12.1.007.
9.2 Помещение должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021. Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
9.3 При работе с электроустановками требования к безопасности должны соответствовать ГОСТ 12.1.19*.
_______________
* Вероятно ошибка оригинала. Следует читать ГОСТ 12.1.019. - Примечание изготовителя базы данных.
9.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.4.004* и быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
_______________
* Вероятно ошибка оригинала. Следует читать ГОСТ 12.1.004. - Примечание изготовителя базы данных.
10 Требования к персоналу
10.1 Проведение исследований осуществляют специалисты с образованием не ниже среднего специального (лаборант, медицинская сестра, фармацевт и т.п.) под руководством лиц, имеющих высшее образование.
10.2 Персонал допускается к работе после прохождения специальной подготовки и инструктажа по соблюдению техники безопасности.
Приложение А (обязательное). Меры предосторожности при работе в ПЦР-лаборатории
Приложение А
(обязательное)
Для исключения ложноположительных результатов исследования и неправильной интерпретации полученных данных, а также чтобы предотвратить неконтролируемое распространение амплифицированных фрагментов, при работе в лаборатории необходимо соблюдать следующие требования:
А.1 ПЦР-лаборатория должна включать следующий набор рабочих зон:
- зона приема и регистрации;
- зона первичной обработки материала;
- зона выделения ДНК;
- зона проведения ПЦР;
- зона детекции продуктов амплификации (отсутствует в случае, если детекция продуктов ПЦР осуществляется по методике ПЦР в реальном времени).
А.1.1 Зона приема и регистрации предназначена для регистрации и хранения поступающего материала.
А.1.2 Зона первичной обработки материала предназначена для сортировки и маркировки образцов, обработки лизирующим буфером, а также первичной инактивации остатков биоматериала.
А.1.3 Зона выделения ДНК предназначена для экстракции ДНК из исследуемого материала, прошедшего первичную обработку в зоне приема и первичной обработки образцов, а также временного хранения проб выделенной ДНК.
А.1.4 Зона проведения ПЦР предназначена для внесения ДНК в реакционную смесь для ПЦР и проведения амплификации. В этой зоне запрещается проводить все другие виды работ с образцами ДНК, растительным материалом, микробиологические и другие виды исследований.
А.1.5 Зона детекции продуктов амплификации предназначена для анализа продуктов ПЦР методом электрофореза. Зона детекции должна быть изолирована в отдельном помещении с тамбуром для смены рабочей одежды и УФ-боксом для проведения электрофореза.
А.2 В ПЦР-лаборатории должны быть предусмотрены вспомогательные помещения [гардероб, кабинет заведующего лабораторией, комната приема пищи, подсобные (складские) помещения, туалет]. Вспомогательные помещения могут быть общими с другими подразделениями учреждения.
А.3 Планировочные решения и размещение оборудования должны обеспечивать поточность движения исследуемого материала. Следует полностью исключить воздухообмен между зоной детекции продуктов амплификации и другими зонами.
А.4 Лаборатория должна быть оборудована водопроводом, канализацией, электричеством, отоплением и приточно-вытяжной или вытяжной вентиляцией. Все помещения лаборатории обеспечиваются достаточным естественным и искусственным освещением. При необходимости в ПЦР-лаборатории могут быть установлены кондиционеры.
А.5 Поверхности стен, пола и потолка в лабораторных помещениях должны быть гладкими, без щелей, легко обрабатываемыми, устойчивыми к действию моющих и дезинфицирующих средств. Полы не должны быть скользкими. Лабораторная мебель должна иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь трещин и швов.
А.6 Помещения на всех этапах ПЦР-анализа должны быть оборудованы бактерицидными лампами в соответствии с действующими нормативными документами.
А.7 Помещения лаборатории должны быть непроницаемы для грызунов и насекомых.
А.8 ПЦР-лабораторию обеспечивают средствами пожаротушения.
А.9 Каждую зону ПЦР-лаборатории оснащают индивидуальным набором соответствующего лабораторного оборудования, расходных материалов и рабочей одежды, используемых только в данной зоне. Комплект лабораторного оборудования определяют с учетом используемых методик проведения ПЦР-анализа, наборов реагентов для выделения нуклеиновых кислот, амплификации и детекции результатов исследований.
А.9.1 Приборы, оборудование и средства измерения, используемые в ПЦР-лаборатории, должны быть технически исправны, иметь технический паспорт и рабочую инструкцию по эксплуатации. Средства измерения регулярно подвергают метрологическому контролю. Используемые приборы должны соответствовать нормам безопасности и электромагнитной совместимости.
А.9.2 Для проведения исследования используют приборы и расходные материалы (микропробирки, наконечники к автоматическим дозаторам), исключающие возможность перекрестной контаминации (загрязнения выявляемой ДНК) исходного материала, экстрактов ДНК. Для этого используют:
- термостаты с твердотельным термоблоком;
- пробирки с плотно закрывающимися крышками;
- одноразовые пробирки, микропробирки и наконечники к автоматическим дозаторам (наконечники должны соответствовать автоматическим дозаторам, а микропробирки для амплификации - амплификаторам (в соответствии с рекомендацией фирмы-производителя прибора);
- специальные контейнеры для сброса использованных наконечников и пробирок, устанавливаемые на рабочих местах.
А.9.3 Приборы, оборудование и упаковки с расходными материалами должны быть маркированы в соответствии с этапами ПЦР-анализа, для которых они предназначены.
А.9.4 Автоматические дозаторы, рабочие поверхности корпусов приборов должны быть устойчивы к действию моющих и дезинфицирующих средств и ультрафиолетового излучения.
А.10 Не допускается хранение исследуемых проб и экстрактов ДНК в одном холодильнике с наборами реагентов.
А.11 В ПЦР-лаборатории используют дезинфицирующие средства, разрешенные к применению в установленном порядке и вызывающие деградацию ДНК.
А.12 Перед началом проведения исследований рабочие поверхности, оборудование и материалы обрабатывают ультрафиолетом в течение необходимого времени (время работы УФ-ламп отражают в специальном журнале по учету работы бактерицидных ламп).
А.13 Весь поступающий материал направляют в зону приема и регистрации, где проводится анализ сопроводительных документов, сличение маркировки доставленных проб и информации, указанной в сопроводительных документах, визуальная оценка качества проб и регистрация в специальном журнале. В случае выявления нарушений составляют акт о возврате материала владельцу или об его уничтожении.
А.14 В зону выделения ДНК пробы материала доставляют в закрытых одноразовых пробирках в виде маркированных аликвот после обработки лизирующим буфером.
А.15 Использованные наконечники для автоматических дозаторов, микропробирки и другие отработанные расходные материалы подвергают химической обработке дезинфицирующими растворами, вызывающими деградацию ДНК. Обработку проводят в зоне, где непосредственно использовались расходные материалы (используя контейнеры для сброса наконечников и микропробирок, установленные на рабочих местах).
А.16 Соблюдают поточность продвижения исследуемого материала и его производных (экстракты ДНК, продукты амплификации).
А.17 Не допускается использование наборов реагентов с истекшим сроком годности или хранившихся в условиях, не соответствующих требованиям, изложенным в инструкциях к наборам.
А.18 По окончании работы пробы материала, подлежащие хранению, экстракты ДНК и наборы реагентов убирают в соответствующие хранилища (холодильники, шкафы и т.д.) с соблюдением требований, указанных в А.17, после чего рабочие поверхности обрабатывают реагентами, вызывающими разрушение ДНК.
А.19 Во всех помещениях лаборатории ежедневно проводят влажную уборку. Каждую зону ПЦР-анализа обеспечивают индивидуальным набором уборочного инвентаря. После завершения уборки проводят обработку ультрафиолетовым излучением в течение необходимого времени.
А.20 Сотрудников обеспечивают спецодеждой для каждой зоны ПЦР-лаборатории. При работе в зоне детекции продуктов амплификации следует использовать бахилы и одноразовые перчатки. Перемещение спецодежды из зоны в зону не допускается. Возможно использование одноразовой спецодежды.
А.21 Каждую зону лаборатории обеспечивают аптечкой стандартной комплектации для оказания первой медицинской помощи.
А.22 Всю необходимую методическую литературу и нормативную документацию следует систематизировать и хранить в зоне приема и регистрации. Инструкции к приборам и наборам реагентов должны находиться по месту использования.
А.23 При возникновении загрязнения продуктами ПЦР зон ПЦР-лаборатории проводят следующие мероприятия:
- утилизацию всех находящихся в загрязненной зоне реактивов;
- утилизацию исследуемых материалов на всех промежуточных стадиях обработки (кроме исходной);
- генеральную уборку, химическую и ультрафиолетовую обработку всех поверхностей лабораторных помещений;
- обработку мебели, рабочих поверхностей, поверхностей корпусов приборов и оборудования, а также спецодежды .
Проведение ПЦР-исследований до завершения вышеназванных мероприятий не допускается.
Приложение Б (рекомендуемое). Интерпретация результатов качественного определения фрагментов видоспецифичной ДНК
Приложение Б
(рекомендуемое)
Б.1 Использование метода электрофореза для детекции продуктов амплификации
В продуктах амплификации положительного контроля наборов для определения фрагментов видоспецифичной ДНК должна присутствовать одна яркая и четкая полоса - специфический фрагмент (см. рисунки Б.1 и Б.2). Размеры специфических фрагментов указаны в таблице Б.1.
Рисунок Б.1 - Электрофореграмма фрагментов видоспецифичной ДНК сои, кукурузы и картофеля, полученных при использовании наборов серии "ПЦР-ядро"
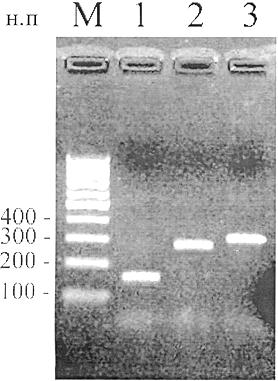
М - маркер молекулярных масс; 1-3 - специфические фрагменты, являющиеся продуктами
амплификации К+: 1 - "LEC-ПЦР-ядро" (164 н.п); 2 - "ZEX-ПЦР-ядро" (273 н.п);
3 - "РАТЕХ-ПЦР-ядро" (300 н.п)
Рисунок Б.1 - Электрофореграмма фрагментов видоспецифичной ДНК сои, кукурузы и картофеля,
полученных при использовании наборов серии "ПЦР-ядро"
Рисунок Б.2 - Электрофореграмма фрагментов видоспецифичной ДНК говядины, свинины и курицы, полученных при использовании наборов серии "ПЦР-ядро"
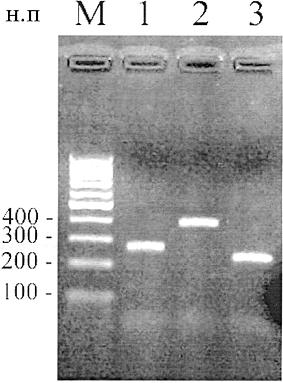
М - маркер молекулярных масс; 1-3 - специфические фрагменты, являющиеся продуктами
амплификации К+: 1 - "BOV-ПЦР-ядро" (274 н.п); 2 - "SUS-ПЦР-ядро" (398 н.п);
3 - "GUL-ПЦР-ядро" (431 н.п)
Рисунок Б.2 - Электрофореграмма фрагментов видоспецифичной ДНК говядины, свинины и курицы,
полученных при использовании наборов серии "ПЦР-ядро"
Таблица Б.1 - Продукты амплификации К+ из наборов реагентов серии "ПЦР-ядро"
Название набора | Предназначение | Размер ампликона (н.п.) |
LEC-ПЦР-ядро | Определение генома сои | 164 |
ZEX-ПЦР-ядро | Определение генома кукурузы | 273 |
РАТЕХ-ПЦР-ядро | Определение генома картофеля | 300 |
BOV-ПЦР-ядро | Определение генома крупного рогатого скота | 274 |
SUS-ПЦР-ядро | Определение генома свиньи | 398 |
GUL-ПЦР-ядро | Определение генома курицы | 431 |
В пробирке с К- любого из наборов для ПЦР не должны присутствовать как специфические, так и неспецифические фрагменты. Допускается присутствие неиспользованных в ходе ПЦР праймеров в виде слабо окрашенной нечеткой полосы размером менее 50 нуклеотидных пар (н.п.).
Положительными, то есть содержащими искомый фрагмент ДНК, считаются пробы, содержащие светящиеся полосы, расположенные на таком же расстоянии от точки старта, что и полоса соответствующего К+.
В случаях, когда в ходе детекции фрагмента ДНК какого-либо образца получен неоднозначный результат, для уточнения результата необходимо повторное проведение амплификации с анализируемым экстрактом ДНК. Если удовлетворительный результат не достигнут таким способом, требуется повторное выделение ДНК из новой пробы исследуемого материала и дополнительная постановка ПЦР.
Б.2 Использование детекции продуктов амплификации в реальном времени
В пробирке с К+ должно наблюдаться увеличение интенсивности флуоресценции (график имеет вид S-образной кривой). Подобная картина должна наблюдаться во всех положительных образцах (рисунок Б.3).
Рисунок Б.3 - Кривая флуоресценции накопленных продуктов ПЦР, полученная в ходе ПЦР в реальном времени
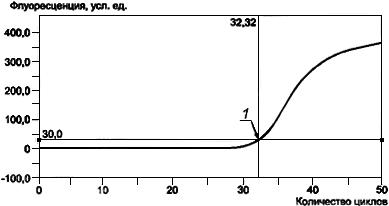
1 - точка начала log-фазы ПЦР и соответствующее ей количество выполненных циклов (32.32)
Рисунок Б.3 - Кривая флуоресценции накопленных продуктов ПЦР,
полученная в ходе ПЦР в реальном времени
В отрицательном контроле не должно происходить накопления продукта ПЦР, поэтому построенный прибором график должен иметь вид прямой линии. Подобная картина должна наблюдаться во всех отрицательных образцах (рисунок Б.4).
Рисунок Б.4 - Показания прибора при отсутствии накопления продуктов ПЦР (отрицательный результат анализа)
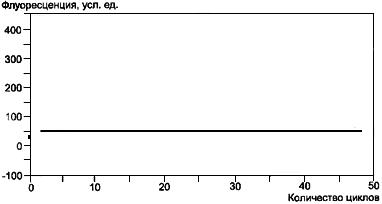
Рисунок Б.4 - Показания прибора при отсутствии накопления продуктов ПЦР
(отрицательный результат анализа)