ГОСТ Р ИСО 11137-2000
Группа Р26
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукции
ТРЕБОВАНИЯ К ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ
Радиационная стерилизация
Sterilization of health care products. Requirements for
validation and routine control. Radiation sterilization
ОКС 11.080
ОКП 94 5120
Дата введения 2001-07-01
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ), ВНИИФТРИ Госстандарта России и Московской медицинской академией им. И.М.Сеченова
ВНЕСЕН Техническим комитетом по стандартизации ТК 383 "Стерилизация медицинской продукции" Госстандарта России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 14 августа 2000 г. N 207-ст
3 Настоящий стандарт содержит аутентичный текст международного стандарта ИСО 11137-95 "Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Введение
Настоящий стандарт содержит требования по обеспечению проведения процесса радиационной стерилизации. К ним относятся документированные программы работ, при помощи которых устанавливаются нормы, обеспечивающие проведение радиационного процесса в регламентированных условиях, при которых производимая продукция постоянно обрабатывается в заданном диапазоне поглощенных доз.
Радиационный процесс - это физический процесс, связанный с облучением изделия ионизирующим излучением. Изделие облучают на специальном оборудовании гамма-излучением радионуклидов кобальта-60 (Со), или цезия-137 (Cs
) или пучком электронного или рентгеновского излучения, генерируемого ускорителем электронов. При правильном проведении радиационная стерилизация является безопасным и надежным промышленным процессом.
Стерилизация является примером процесса, эффективность которого не может быть проверена ретроспективным контролем и испытанием продукции. Важно понимать, что для валидированного и точно контролируемого процесса стерилизации облучение не является единственным условием гарантии того, что изделие стерильно и пригодно для использования по назначению. Следует уделять внимание микробиологическому состоянию сырья и/или комплектующих, микробиологическим защитным свойствам упаковки и контролю внешних условий изготовления, сборки, упаковки и хранения продукции.
Стерильный продукт - это продукт, который не содержит жизнеспособных микроорганизмов. Продукция, изготовленная в контролируемых условиях, может быть до стерилизации загрязнена микроорганизмами, хотя обычно в небольшом количестве. Такая продукция, по определению, нестерильна. Цель стерилизации - дезактивировать микробиологическую контаминацию на нестерильной продукции. Дезактивация микроорганизмов физическими и химическими методами подчиняется экспоненциальному закону. Следовательно, можно рассчитать конечную вероятность выживания микроорганизмов независимо от значения стерилизующей дозы или способа обработки. Вероятность выживания является функцией числа и типа (штамма) микроорганизмов, имеющихся на продукции, процесса гибели при стерилизации и, в отдельных случаях, условий окружающей среды, в которой находятся микроорганизмы при обработке. Из этого следует, что стерильность конкретного объекта в общем числе стерилизуемой продукции не может быть гарантирована в абсолютном смысле.
Уровень обеспечения стерильности () вычисляется математически и определяет вероятность наличия жизнеспособного микроорганизма на отдельной единице продукции.
Первичный изготовитель несет полную ответственность за обеспечение правильности и адекватности всех операций при стерилизации и испытаниях на соответствие техническим требованиям на данную продукцию. В то же время ответственный за облучение персонал отвечает за обработку изделий в требуемом диапазоне доз в соответствии с требованиями валидированного процесса.
В связи с введением ГОСТ 30392-95/ГОСТ Р 50325-92 приложение С к ИСО 11137 о дозиметрии в настоящий стандарт не включено.
1 Область применения
1.1 Настоящий стандарт устанавливает требования к валидации, управлению и текущему контролю процесса радиационной стерилизации медицинской продукции. Он распространяется на радиационно-технологические установки непрерывного и циклического типа, использующие ионизирующее излучение радионуклидов Со и Cs
, а также на радиационно-технологические установки с использованием генераторов электронного и тормозного излучения.
Дополнительная информация приведена в приложениях А-С. В настоящем стандарте не рассматривается проектирование, лицензирование, обучение оператора и факторы, связанные с радиационной безопасностью, а также оценка пригодности продукции для использования по назначению после радиационной стерилизации. Использование биологических индикаторов для валидации или контроля процесса и испытания на стерильность выпускаемой продукции не рассматривается, поскольку эти индикаторы для процесса радиационной стерилизации не рекомендуются.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 30392-95/ГОСТ Р 50325-92 Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации
ГОСТ Р ИСО 9001-96* Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96* Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании.
________________
* На территории Российской Федерации действует ГОСТ Р ИСО 9001-2001. Здесь и далее по тексту. - Примечание изготовителя базы данных.
ГОСТ Р ИСО 11737-1-2000 Стерилизация медицинской продукции. Микробиологические методы. Оценка популяции микроорганизмов в продукции.
ИСО 11737-2-98 Стерилизация медицинских изделий. Микробиологические методы. Испытания на стерильность, проводимые при валидации процессов стерилизации.
3 Определения
В настоящем стандарте используют следующие термины с соответствующими определениями:
3.1 Медицинская продукция (health care product) и соответствующие термины:
3.1.1 партия, серия (batch): Определенное количество нерасфасованной, промежуточной или готовой продукции, которая изготовлена в течение определенного цикла производства и имеет однородные характеристики и качество.
3.1.2 медицинская продукция (health care product): Медицинские изделия, лекарственные средства (фармацевтические и биологические) и изделия для диагностики in vitro.
3.1.3 первичный изготовитель (primary manufacturer): Компания или организация, ответственная за изготовление, выпуск, качество и безопасность медицинской продукции.
3.1.4 категория продукции (product category):
1) Для стерилизации гамма- или тормозным излучением - Продукция с одинаковой объемной плотностью, обусловливающей одинаковый характер распределения доз.
2) Для стерилизации электронным излучением - Продукция с одинаковой максимальной поверхностной плотностью, обусловливающей одинаковый характер распределения доз.
3.1.5 единица продукции (product unit): Медицинская продукция, комплект изделий или компонентов в первичной упаковке.
3.2 Радиационно-технологическая установка (Irradiator) и соответствующие термины:
3.2.1 радиационно-технологическая установка периодического действия (batch (type) irradiator): Радиационно-технологическая установка, у которой загрузка и выгрузка контейнеров для облучения производится, когда источник ионизирующего излучения находится в положении хранения.
3.2.2 объемная плотность (bulk density): Масса продукции и всей соответствующей упаковки в контейнере для облучения, деленная на объем, определяемый размерами внешней упаковки.
3.2.3 радиационно-технологическая установка непрерывного действия (continuous (type) irradiator): Установка, которая может быть загружена продукцией и разгружена, когда источник находится в рабочем положении.
3.2.4 контейнер для облучения (irradiation container): Подвеска, тележка, поддон или другой контейнер, в котором производится облучение продукции.
3.2.5 радиационно-технологическая установка (РТУ) (irradiator): Комплекс средств, обеспечивающий безопасное и надежное проведение стерилизации, имеющий в своем составе источник излучения, конвейер и механизмы привода источника, а также устройства безопасности и защиту.
3.2.6 ответственный за облучение (irradiator operator): Компания или организация, ответственная за облучение медицинской продукции требуемой дозой.
3.2.7 поверхностная плотность (surface density): Масса элементарного столбика продукции, вырезанного в направлении распространения пучка электронов вдоль всего контейнера для облучения до самой отдаленной его точки, отнесенная к площади поперечного сечения столбика.
Примечание - Единица поверхностной плотности - г/см.
3.2.8 установка таймера (timer setting): Выбранный интервал времени, в течение которого контейнер для облучения должен находиться в каждой позиции при облучении. Она определяет продолжительность облучения.
3.3 Источники излучения (radiation sources) и соответствующие термины:
3.3.1 средний ток пучка (average beam current): Усредненный во времени поток электронов, производимый генератором электронов.
3.3.2 тормозное излучение (bremsstrahlung): Фотонное излучение с непрерывным энергетическим спектром, возникающее при уменьшении кинетической энергии заряженных частиц.
Примечание - На практике тормозное излучение получают при торможении электронов в каком-либо материале (конвертере). Спектр тормозного излучения зависит от энергии электронов, материала и толщины конвертера и содержит фотоны с энергией от нуля до максимальной энергии электронов.
3.3.3 конвертер (converter): Мишень для электронов высокой энергии, обычно из материала, имеющего высокий атомный номер, в котором возникает тормозное излучение в результате потери энергии падающих электронов.
3.3.4 электронный пучок (electron beam): Непрерывный или импульсный поток электронов высокой энергии.
3.3.5 энергия электронов (electron energy): Кинетическая энергия электронов в электронном пучке.
3.3.6 гамма-излучение (gamma ray): Коротковолновое электромагнитное излучение (фотоны), испускаемое радиоактивными веществами в процессе ядерных реакций.
Примечания
1 Имеет широкое применение.
2 Гамма-излучение, используемое для облучения медицинской продукции, - это проникающее фотонное излучение высокой энергии, испускаемое радионуклидными источниками Со или Cs
.
3.3.7 активность источника (source activity): Мера радиоактивности радионуклида Со или Cs
, измеряемая в беккерелях или кюри (1 Кюри (Ки) =3,7х10
беккерелей (Бк), где 1 Бк =1 распаду в секунду).
3.3.8 Тормозное излучение (x-rays): Коротковолновое электромагнитное излучение, возникающее при ускорении, торможении или отражении электронов высокой энергии сильными электрическим или магнитным полями атомов мишени.
Примечания
1 Имеет широкое применение.
2 Термин включает как тормозное излучение, возникающее при торможении электрона около атомного ядра, так и характеристическое моноэнергетическое излучение, возникающее при переходе атомных электронов на более низкие энергетические уровни. В настоящем стандарте определение применяется для тормозного излучения.
3.4 Термины, относящиеся к измерению дозы (dose measurement):
3.4.1 поглощенная доза (absorbed dose): Количество энергии излучения, переданное единице массы облучаемого материала. Единица поглощенной дозы - грей (Гр). 1 Гр эквивалентен поглощению 1 Дж на 1 кг (равняется 100 рад).
3.4.2 доза (dose): (см. "поглощенная доза").
3.4.3 дозиметр (dosimeter): Устройство или система, имеющие воспроизводимый и поддающийся измерению отклик к ионизирующему излучению, которые используются для измерения поглощенной дозы в данном материале.
3.4.4 дозиметрия (dosimetry): Измерение поглощенной дозы с помощью дозиметров.
3.4.5 дозиметрическая система (dosimetry system): Система, используемая для определения поглощенной дозы, состоящая из детекторов, измерительной аппаратуры и методики ее применения.
3.4.6 дозиметр - первичный эталон (primary standard dosimeter): Дозиметр самого высокого метрологического качества, утвержденный и хранящийся как эталон единицы поглощенной дозы национальной или международной организацией по стандартизации.
3.4.7 образцовый дозиметр (reference standard dosimeter): Дозиметр высокого метрологического качества, используемый как эталон для обеспечения единства измерений и передачи размера единицы поглощенной дозы от первичного эталона рабочим дозиметрам.
3.4.8 рабочий дозиметр (routine dosimeter): Дозиметр, калиброванный с помощью первичного, рабочего эталона или эталона сравнения и используемый для технических измерений поглощенной дозы.
3.4.9 дозиметр - эталон сравнения (transfer standard dosimeter): Дозиметр, часто образцовый дозиметр (рабочий эталон), предназначенный для использования в качестве вспомогательного средства измерения для сравнения дозиметрических измерений, проводимых в разных местах.
3.5 Валидация (validation) и соответствующие термины:
3.5.1 калибровка (calibration): Сличение измерительной системы или прибора неизвестной точности с измерительной системой или прибором известной точности (в соответствии с поверочной схемой), с целью обнаружения, установления соотношений, учета или устранения регулированием любых отклонений показаний калибруемой измерительной системы или прибора от заданных допусков.
3.5.2 аттестация установленного оборудования (installation qualification): Получение и документальное подтверждение того, что оборудование поставлено, установлено в соответствии с техническими требованиями и функционирует с заданными параметрами при использовании в соответствии с инструкциями по эксплуатации.
3.5.3 национальный эталон (national standard): Эталон, признанный решением национальных органов в качестве исходного для всех остальных эталонов рассматриваемой величины в стране.
3.5.4 аттестация процесса (process qualification): Получение и документальное подтверждение уверенности в том, что процесс стерилизации обеспечит производство медицинской продукции необходимого качества.
3.5.5 аттестация продукции (product qualification): Получение и документальное подтверждение уверенности о том, что медицинская продукция будет пригодна после облучения для использования по назначению.
3.5.6 валидация (validation): Документально подтвержденное доказательство того, что рассматриваемый процесс с высокой степенью уверенности будет постоянно давать продукцию, соответствующую заданным характеристикам и требованиям к качеству.
3.6 Стерильность (sterile) и соответствующие термины:
3.6.1 стерильность (sterile): Отсутствие жизнеспособных микроорганизмов.
Примечание - На практике утверждение об абсолютном отсутствии любых форм жизнеспособных микроорганизмов не может быть доказано (см. 3.6.3).
3.6.2 уровень обеспечения стерильности (УС) (sterility assurance level (SAL): Вероятность наличия жизнеспособного микроорганизма на единице продукции после стерилизации.
Примечание - УС обычно выражается величиной 10.
3.6.3 стерилизация (sterilization): Валидированный процесс освобождения продукции от жизнеспособных микроорганизмов.
Примечание - Природа отмирания микроорганизмов в процессе стерилизации описывается экспоненциальной функцией. Поэтому можно говорить только о вероятности наличия микроорганизмов на любой отдельно взятой единице продукции. Вероятность может быть очень малой, но она никогда не может быть равна нулю. Вероятность может быть выражена в виде уровня обеспечения стерильности (УС).
3.6.4 стерилизующая доза (sterilization dose): Минимальная поглощенная доза, необходимая для достижения указанного уровня обеспечения стерильности (УС).
3.7 Термины, связанные с определением дозы
3.7.1 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на продукции.
Примечание - В контексте радиационной стерилизации бионагрузка определяется непосредственно перед стерилизацией (инициальная контаминация).
3.7.2 положительная доля (fraction positive): Частное от деления количества образцов, давших положительный результат контроля стерильности, на общее количество исследованных образцов.
3.7.3 возрастающая доза (incremental dose): Доза из серии значений доз, при которых облучается определенное количество единиц продукции или их частей, используемая в методе определения стерилизующей дозы для установления или подтверждения ее значения.
3.7.4 радиационная стойкость (radiation stability): Способность медицинской продукции сохранять свои функциональные свойства в течение всего срока годности после облучения максимальной дозой.
3.7.5 проверка стерилизующей дозы (sterilization dose audit): Действия, определяющие необходимость изменения стерилизующей дозы.
3.8 Термины, употребляемые в приложении В
3.8.1 испытание на стерильность (sterility testing): Испытание, выполненное с целью установления наличия жизнеспособных микроорганизмов на единице продукции.
3.8.2 испытание на стерильность с положительным результатом (positive sterility test): Испытания, которые обнаруживают рост микроорганизмов после инкубации.
3.8.3 испытания на стерильность с отрицательным результатом (negative sterility test): Испытания, которые показывают отсутствие роста микроорганизмов после инкубации.
3.8.4 ложноположительный результат (false positive): Результат испытания, при котором помутнение испытательной среды, являющееся следствием вторичного загрязнения микроорганизмами или взаимодействием между образцом и испытательной средой, приписывается испытуемому образцу.
3.8.5 ложноотрицательный результат (false negative): Результат испытания, который интерпретируют как отсутствие роста в то время, когда рост присутствует, но не обнаруживается, или когда жизнеспособные микроорганизмы не смогли вырасти.
3.8.6 аэробный организм (aerobic organism): Микроорганизм, использующий кислород в качестве акцептора электронов при метаболизме.
3.8.7 анаэробный организм (anaerobic organism):
1) Микроорганизмы, которые не используют кислород как акцептор электронов при метаболизме.
2) Микроорганизмы, которые растут только при отсутствии кислорода.
3.8.8 факультативный микроорганизм (facultative organism): Микроорганизм, способный как к аэробному, так и к анаэробному метаболизму.
3.8.9 часть продукции для испытания () (sample item portion (SIP)): Определенная часть единицы медицинской продукции, которую используют при испытаниях.
3.8.10 проверочная доза (verification dose) (**, кГр): Значение дозы, обеспечивающее
![]() 10
10 для единицы продукции или ее части и используемое в методике определение стерилизующей дозы при ее установлении или подтверждении.
_____________
** Обозначение дозы.
3.8.11 , кГр: Доза излучения при определенных условиях обработки, необходимая для уменьшения однородной популяции микроорганизмов в 10 раз в предположении, что инактивация микроорганизмов подчиняется кинетическому уравнению первого порядка.
4 Документация
Чтобы гарантировать воспроизводимость валидации, производственные процессы и все другие элементы, которые будут влиять на процесс стерилизации, должны быть полностью документированы. Оформление и ведение документации следует выполнять в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
5 Персонал
Должен быть назначен квалифицированный персонал, ответственный за валидацию и текущий контроль радиационной стерилизации в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6 Валидация процесса стерилизации
6.1 Общие положения
Валидация процесса стерилизации должна включать следующие элементы:
a) аттестацию продукции, облученной на предварительно аттестованной установке радиационной стерилизации;
b) аттестацию установленного оборудования;
c) аттестацию процесса с использованием конкретной или моделирующей ее продукции на аттестованном оборудовании;
d) процедуру официального рассмотрения и утверждения администрацией документации по перечислениям а), b) и с);
e) действия, направленные на поддержание результатов валидации.
На рисунке 1 показана схема типичной программы валидации.
Рисунок 1 - Элементы схемы типичной программы валидации
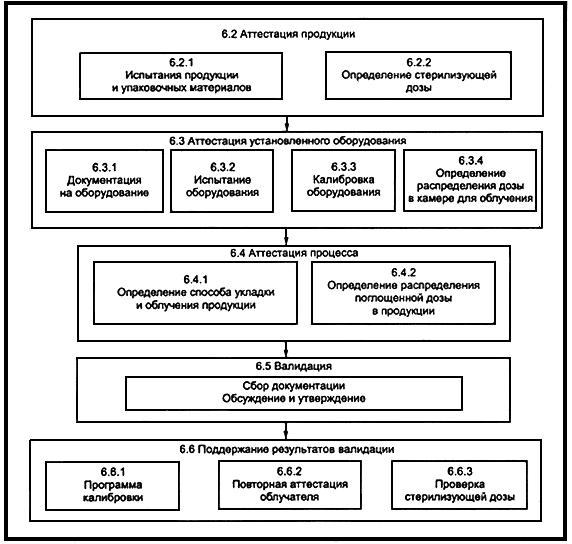
Рисунок 1 - Элементы схемы типичной программы валидации
6.2 Аттестация продукции
6.2.1 Испытания продукции и упаковочных материалов
До использования метода радиационной стерилизации для производства медицинской продукции необходимо оценить влияние ионизирующего излучения на материалы, из которых изготовлена продукция (и/или ее компоненты) и упаковочные материалы. Должно быть показано, что качество, безопасность и функциональные свойства продукции сохраняются в течение всего срока годности.
Эта проверка должна охватывать все характеристики, существенно влияющие на качество, безопасность и функциональные свойства продукции. Обычно при разработке программы испытаний должны быть приняты во внимание: возможные изменения процесса изготовления продукции и его допуски, диапазон доз излучения, вид излучения, сырье и условия хранения. Для каждого вида продукции и упаковочного материала должна быть установлена максимально допустимая доза излучения.
Руководство по испытанию изделий и упаковочных материалов приведено в приложении А.
6.2.2 Выбор стерилизующей дозы
6.2.2.1 Для определения стерилизующей дозы нужно определить количество и радиорезистентность естественной микрофлоры изделия. Доза должна быть достаточной для обеспечения заранее заданного уровня стерильности ().
При выборе стерилизующей дозы используется один из двух подходов:
a) выбор стерилизующей дозы, использующий:
1) информацию о бионагрузке или
2) информацию, полученную при облучении возрастающей дозой.
Примечание - Методы определения дозы для радиационной стерилизации приведены в приложении В;
b) выбор стерилизующей дозы 25 кГр, после соответствующего обоснования.
6.2.2.2 Основными техническими требованиями при получении информации, необходимой для выбора стерилизующей дозы с использованием сведений о бионагрузке или положительной доле, и подтверждения выбора значения 25 кГр должны быть:
a) использование услуг компетентных микробиологических лабораторий;
b) выполнение микробиологических испытаний в соответствии с ГОСТ Р ИСО 11737-1 и/или ИСО 11737-2 (см. также [5]);
c) проведение облучения продукции на установках с использованием:
- источников ионизирующего излучения Co или Cs
или
- пучков электронов и тормозного излучения при значениях энергии излучения и мощности дозы, подобных тем, которые используют в производстве изделий и способных обеспечить облучение с достаточной точностью при значениях дозы, начиная с 1 кГр.
6.2.3 Передача стерилизующей дозы
При передаче продукции с одной установки на другую значение стерилизующей дозы, определенное в соответствии с 6.2.1 и 6.2.2 для первой установки, следует использовать для второй, принимая во внимание следующие данные:
При передаче продукции с установки с электронным пучком или тормозным излучением на любую другую радиационно-технологическую установку (электронный пучокэлектронный пучок; тормозное излучение
тормозное излучение; электронный пучок
тормозное излучение; электронный пучок
гамма-излучение; тормозное излучение
гамма излучение) должны быть получены данные, доказывающие, что различия характеристик двух установок, в частности энергии излучения и мощности дозы, а также распределения поглощенной дозы в продукции, не снижают уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
При передаче стерилизующей дозы между двумя гамма-установками должны быть данные, доказывающие, что отличия в распределении поглощенной дозы в продукции для двух установок не влияют на уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
6.3 Аттестация оборудования
Должна быть составлена, утверждена и выполняться программа аттестации оборудования.
6.3.1 Документация на оборудование
Должна быть документация, описывающая конструкцию и действие радиационно-технологической установки (РТУ). Эта документация должна храниться в течение всего периода эксплуатации установки и включать в себя следующие документы:
а) технические требования на РТУ и его характеристики;
b) описание расположения РТУ в пределах операционного помещения относительно средств, обеспечивающих разделение необлученной и облученной продукции;
c) описание конструкции и действия конвейерной системы;
d) описание конструкции, материалов и размеров контейнеров для облучения;
е) описание правил эксплуатации РТУ и конвейерной системы;
f) паспорта на источники ионизирующего излучения с указанием первоначальной активности и расположения в РТУ; схемы и протоколы зарядки;
g) любые изменения, сделанные в РТУ.
Следует вести и другую документацию, описывающую аппаратуру управления, контроля и записи критических параметров процесса во время облучения. Такая документация должна храниться в соответствии с требованиями ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
Для гамма-установки критическими параметрами процесса являются:
продолжительность облучения, скорость конвейера и измеряемая доза.
Для установок с электронным пучком или тормозным излучением критические параметры процесса должны включать характеристики пучка электронов (средний ток пучка электронов, энергия электронов, ширина развертки пучка электронов), скорость конвейера, а также должны иметь схему обратной связи скорости движения конвейера и/или схему управления обратной связью скорости движения конвейера с измеряемой дозой облучения.
6.3.2 Испытание оборудования
Технологическое оборудование, включающее источник излучения, механизмы конвейера, устройства безопасности и вспомогательные системы, должно испытываться для проверки удовлетворительной работы в соответствии с технической документацией. Методы испытаний и результаты должны быть документированы.
6.3.3 Калибровка оборудования
Для того чтобы гарантировать, что оборудование и дозиметрические системы калиброваны (в соответствии с поверочной схемой) и погрешность находится в заданных границах, должна выполняться программа калибровки в соответствии с ГОСТ Р ИСО 9001.
Для радиационно-технологических гамма-установок программа включает калибровку таймеров цикла облучения или скорости конвейера, взвешивающего оборудования и дозиметрических систем.
Для радиационно-технологических установок с электронным или тормозным излучением программа включает калибровку характеристик электронного пучка, скорости перемещения контейнера для облучения, взвешивающего оборудования и дозиметрических систем.
Для валидации и текущего контроля процесса радиационной стерилизации следует использовать дозиметры с известной точностью. Необходимо иметь надлежащие методики дозиметрии, которые должны включать в себя указания по статистической обработке результатов измерения дозы и ведению документации.
Примечание - Дозиметры, дозиметрия и используемое оборудование - по ГОСТ 30392/Р 50325.
6.3.4 Определение распределения дозы в камере РТУ
Для определения значений дозы и ее воспроизводимости проводят исследование распределения дозы в РТУ.
Для радиационно-технологических гамма-установок и установок с тормозным излучением исследование распределения дозы должно быть выполнено в контейнерах, заполненных до проектных уровней материалом с однородной плотностью, равной или близкой объемной плотности облучаемого продукта, для которых РТУ должна использоваться. Поглощенная доза определяется в различных точках внутри контейнера.
Если прохождение продукции через камеру для облучения происходит по разным маршрутам, исследование распределения дозы должно быть выполнено для каждого из них.
Для радиационно-технологической установки с электронным излучением исследование распределения дозы должно быть выполнено в материале однородной плотности. Полученное распределение дозы характеризует ее распределение по объему транспортируемого через зону облучения материала. Оно должно также установить соотношение между дозой, распределением дозы и рабочими параметрами ускорителя во всем диапазоне значений, используемом для облучения продукции. Если на РТУ имеется более одного маршрута прохождения продукции через РТУ, определение распределения дозы должно быть выполнено для каждого маршрута.
Все отчеты, протоколы, включая протоколы режимов эксплуатации радиационно-технологической установки, результаты и выводы, сделанные на основании измерения распределения дозы в РТУ, необходимо хранить и пересматривать в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.4 Аттестация процесса
6.4.1 Определение способа укладки продукции
Способ укладки продукции должен быть определен для каждого вида продукции. Инструкции по укладке продукции должны включать данные, указанные в 6.4.1.1, 6.4.1.2.
6.4.1.1 Для гамма-установок и установок с тормозным излучением:
a) описание упакованной продукции, включая размеры и плотность, допустимые изменения этих параметров и, если необходимо, ориентацию продукта в упаковке;
b) описание способа размещения продукции в контейнере для облучения;
c) описание контейнера для облучения и его размеров.
6.4.1.2 Для установок с электронным пучком:
a) описание упакованной продукции, включая ориентацию изделия относительно направления движения конвейера и направления электронного пучка, количество единиц продукции в упаковке, размеры и массу упаковки, ориентацию продукции в упаковке и допустимые изменения этих параметров;
b) описание способа укладки продукции внутри контейнера для облучения;
c) описание контейнера для облучения и его размеры.
6.4.2 Определение распределения дозы в продукции
Распределение дозы в продукции определяют для идентификации зон минимальной и максимальной поглощенной дозы в пределах контейнера с изделиями и оценки воспроизводимости процесса. В дальнейшем эта информация должна использоваться при выборе положения контрольной точки для измерения дозы во время проведения рабочего процесса.
Определение распределения дозы должно быть выполнено для объема выборки контейнеров для облучения, достаточного, чтобы определить разброс значений поглощенной дозы между представленными контейнерами, особенно в зонах, где ожидается максимальная и минимальная дозы, и в контрольной точке для текущего дозиметрического контроля.
Определение распределения дозы должно быть выполнено для всего диапазона плотностей данной категории облучаемой продукции независимо от дозы. Схемы загрузки и движения изделий при облучении должны учитываться при исследовании распределения поглощенной дозы в продукции.
Установки, на которых обрабатывается только такая продукция, для которой имеются те же самые характеристики распределения поглощенной дозы, что и характеристики, полученные при аттестации, должны отвечать требованиям распределения дозы в продукции для валидации процесса. Если объемная плотность и размеры образца изделия недостаточно охарактеризованы при текущем исследовании распределения поглощенной дозы, то должно быть проведено дополнительное исследование распределения поглощенной дозы.
Все протоколы, в том числе об условиях облучения, результаты и выводы, сделанные на основании анализа распределения поглощенной дозы, следует хранить в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.5 Валидация
Информация, собранная или полученная при аттестации продукции, установленного оборудования и процесса, должна быть документирована, рассмотрена компетентным экспертом или экспертной группой с целью оценки возможности ее использования и должна храниться в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.6 Поддержание результатов валидации
6.6.1 Программа калибровки
Повторная калибровка оборудования и дозиметрических систем (см. 6.3.3) должна выполняться через установленные интервалы времени, определяемые с учетом стабильности работы и целей в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.6.2 Повторная аттестация радиационно-технологической установки
При изменениях в радиационно-технологической установке, которые влияют на распределение дозы в облучаемом объекте, следует повторить всю процедуру аттестации установки или ее часть (см. 6.3).
6.6.3 Проверка стерилизующей дозы
Проверка должна выполняться с определенной, указанной в документации, периодичностью. Чтобы определить возможность продления использования значения стерилизующей дозы, проверка должна выполняться после любого изменения уровня или характера бионагрузки. При отсутствии подобных изменений проверку проводят не реже одного раза в три месяца.
7 Текущий контроль процесса
Текущий контроль процесса включает контроль и наблюдение за технологическим оборудованием, перемещением продукции до, в течение и после облучения, текущее и профилактическое техническое обслуживание, текущий дозиметрический контроль, обеспечение непрерывности процесса и ведение документации.
7.1 Технические требования к процессу
Для каждого вида или категории продукции должны быть разработаны технические требования к процессу, которые должны включать следующие данные:
a) перечень видов продукции, охватываемой данными техническими требованиями;
b) максимально допустимую дозу и стерилизующую дозу (6.2);
c) схему укладки продукции и соотношение между дозой в контрольной точке, и максимальной и минимальной дозами (6.4.1);
d) положение (положения) рабочего дозиметра для текущего контроля (положение контрольной точки);
e) для стерилизации гамма-излучением - соотношение между плотностью продукции, дозой и мощностью дозы в продукции и активностью источника;
f) для стерилизации электронным пучком и тормозным излучением - соотношение между характеристиками пучка электронов, скоростью конвейера, конфигурацией продукции и дозой.
В случаях, когда требуются многократные облучения продукции, некоторые из которых включают переориентацию продукции, эти требования также должны быть включены в документацию на процесс.
7.2 Обращение с продукцией
Следует разработать и вести документацию, описывающую обращение с продукцией до, во время и после радиационной стерилизации. При обращении с продукцией и ее хранении следует принимать меры, предотвращающие дополнительную контаминацию микроорганизмами.
Следует вести систему учета продукции при получении, погрузке, разгрузке последующем облучении и выпуске.
7.2.1 Отгрузка и получение продукции
Для обеспечения учета продукции производственные записи о продукции, подлежащей стерилизации, должны включать количество полученной продукции. Любое несоответствие между количеством полученной продукции и количеством, указанным в транспортных документах по отгрузке или передаче продукции, должно быть выяснено до его обработки.
7.2.2 Хранение продукции до и после облучения
Продукция до и после стерилизации должна храниться в отдельных зонах. Если эти зоны предназначены не только для хранения нестерильной продукции или только для хранения стерильной продукции, соответственно, или если зоны хранения отдалены от мест загрузки и выгрузки, то должны использоваться индивидуальные поддоны или продукт должен иметь четкую маркировку, отражающую его состояние.
7.3 Техническое обслуживание
Работы по техническому обслуживанию оборудования (обычно рекомендуемые поставщиком) должны осуществляться и документально оформляться в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
7.4 Облучение продукции
7.4.1 Контроль процесса
Радиационно-технологическую установку следует эксплуатировать и обслуживать в соответствии с документами, предназначенными для обеспечения полного выполнения установленных и документированных требований к процессу.
7.4.1.1 Радиационно-технологическая гамма-установка
a) Периодический контроль. Для данной продукции или категории продукции необходимо контролировать установку таймера или скорость конвейера и делать поправку на распад источника ионизирующего излучения. Необходимо иметь резервный таймер, чтобы иметь возможность контролировать любые изменения от первоначально установленного времени облучения.
Облучатель должен иметь контрольные устройства для гарантии того, что он находится в правильном рабочем положении.
b) Непрерывный контроль. Необходимо следить за положением источника, установкой таймера и движением контейнеров для облучения.
с) Укладка продукции. Продукция должна размещаться в контейнере для облучения в соответствии со схемой укладки для данного типа продукции.
7.4.1.2 Радиационно-технологические установки с электронным пучком и тормозным излучением
a) Периодический контроль. Параметры электронного пучка и скорость конвейера должны регулироваться автоматически.
b) Непрерывный контроль. Необходимо контролировать параметры электронного пучка и скорость конвейера для обнаружения отклонений процесса.
c) Укладка продукции. Продукция должна размещаться в контейнере для облучения в соответствии со схемой укладки данного типа продукции.
7.4.2 Прерывание процесса
Если происходит остановка процесса во время стерилизации, и при этом продолжение процесса откладывается на неопределенное время, необходимо исследовать влияние остановки процесса на микробиологическое состояние продукции и принять соответствующие действия.
Для изделий, способных поддерживать рост микроорганизмов, в технологическом регламенте должен быть указан максимальный промежуток времени, который может пройти между моментами остановки и завершения стерилизации, условия обращения при хранении и перемещении в период остановки, а также условия завершения облучения.
Примечание - Для изделий, не способных поддерживать рост микроорганизмов, действие дозы излучения носит кумулятивный характер и, таким образом, прерывание процесса облучения не оказывает заметного воздействия.
7.4.3 Дозиметрический контроль
Для текущего контроля процесса облучения должны использоваться рабочие дозиметры. Чувствительные к ионизирующему излучению визуальные индикаторы не должны использоваться как доказательство удовлетворительной радиационной обработки или как единственное средство отличать облученные изделия от необлученных.
7.4.3.1 Положение контрольной точки
Положение контрольной точки должно быть определено из анализа данных, полученных при измерениях распределения поглощенной дозы в продукции. Для обеспечения надлежащего размещения дозиметров описание положений контрольных точек должно быть частью технических требований на данный процесс. Дозиметры следует размещать в месте, для которого известно соотношение минимальной и максимальной доз.
7.4.3.2 Периодичность контроля
Процесс должен контролироваться через установленные интервалы времени количеством дозиметров, достаточным, чтобы показать, что поглощенная доза в продукции находится в интервале, заданном техническими требованиями на процесс.
Для радиационно-технологических гамма-установок в РТУ всегда должен находиться, по крайней мере, один контейнер для облучения с дозиметром. При нескольких маршрутах движения продукции каждый маршрут должен сопровождаться, по крайней мере, одним дозиметром в РТУ.
Для радиационно-технологических установок с электронным пучком и тормозным излучением необходимо использовать достаточное количество дозиметров с определенным интервалом, чтобы гарантировать, что вся продукция во время облучения получила стерилизующую дозу.
7.4.3.3 Анализ
После облучения должны быть измерены и зарегистрированы показания дозиметров. Все текущие дозиметрические данные должны быть проанализированы. Результаты измерения дозы должны сравниваться со значениями доз, предусмотренными документацией на процесс.
Должно быть проанализировано любое отклонение показаний дозиметров (отдельного дозиметра или среднего значения для нескольких дозиметров) за установленные границы. Если для измерений в контрольных точках используются показания нескольких дозиметров, а показание отдельного дозиметра имеет отклонение большее, чем погрешность данной дозиметрической системы, этот случай также должен быть проанализирован. Продукция, для которой получены такие данные, не может быть реализована до получения удовлетворительных результатов исследований и получения документа, удостоверяющего ее пригодность для реализации.
7.5 Документация на процесс
Для каждого вида продукции необходимо иметь утвержденную уполномоченным лицом документацию на процесс, в которой должна быть представлена следующая информация:
a) количество поступившей продукции с указанием кода и номера партии продукции (если имеется);
b) схема укладки продукции;
c) размещение и возврат дозиметров;
d) номер партии стерилизуемой продукции;
e) необходимая стерилизующая доза и максимально допустимая доза;
f) параметры процесса:
- установка таймера цикла и/или скорости конвейера (гамма-установки),
- характеристики пучка и скорость конвейера (ускорителя электронов и генератора тормозного излучения);
g) данные учета продукции, загруженной в контейнер для облучения;
h) дата (даты) стерилизации;
i) данные учета продукции, выгруженной из контейнера для облучения;
j) данные дозиметрии и результаты анализа;
k) данные учета отгруженной продукции;
l) записи параметров процесса:
- о работе конвейера и положении источника (гамма-установки),
- о параметрах пучка и скорости конвейера (ускорителя электронов и генератора тормозного излучения);
m) использованный маршрут следования продукции (для радиационно-технологических установок, которые имеют различные внутренние маршруты);
n) прерывание процесса и принятые действия;
о) отклонения течения процесса и принятые действия.
7.6 Приемка стерилизации
Когда имеются все записи, показывающие, что процесс стерилизации выполняет требования настоящего стандарта, процесс стерилизации считается принятым.
Примечание - Для того, чтобы продукция могла реализовываться и распространяться как стерильная, потребуются дополнительные отчеты о процессе производства и приемочном контроле изделия в соответствии с системой качества/планом контроля качества (ГОСТ Р ИСО 9001 / ГОСТ Р ИСО 9002).
Настоящий стандарт не требует проведения испытания на стерильность конечной продукции.
8 Управление и контроль
Управление и контроль процесса радиационной стерилизации должны быть полностью документированы и приведены в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
Контроль процесса радиационной стерилизации может достичь своей цели только в том случае, если все методики валидации и производства стандартизованы и документированы, а эти документы, в свою очередь, контролируются. Например, большое значение для обеспечения эффективности этих методик имеют внутренние аудиторские проверки, а записи об изменениях и их результатах имеют большое значение для анализа в будущем.
ПРИЛОЖЕНИЕ А (справочное). Испытания изделий и упаковочных материалов
ПРИЛОЖЕНИЕ А
(справочное)
Настоящее приложение дает руководство по испытанию медицинских изделий, и относится к медицинским изделиям, изготовленным из полимерных материалов. Для другой медицинской продукции влияние облучения ионизирующим излучением на другие свойства, не упомянутые в этом приложении, необходимо исследовать.
До выбора метода радиационной стерилизации для медицинских изделий важно исследовать влияние ионизирующего излучения на стабильность свойств материалов изделия или его частей. Известно, что некоторые материалы, например, полистирол, меньше подвержены действию ионизирующего излучения, чем другие, например, политетрафторэтилен или полиоксиметилен, поэтому радиационная стойкость любого изделия будет зависеть как от материала, так и от метода его переработки (таблица А.1). Поэтому должна быть выполнена программа исследований, демонстрирующая, что изделия сохраняют свои функциональные свойства в течение всего срока годности.
Таблица А.1 - Общие правила выбора радиационно стойких материалов
| При выборе или разработке радиационно стойких материалов применяется несколько правил. Согласно общему правилу все пластмассы можно классифицировать как материалы, молекулы которых: |
Испытанию должны подвергаться все свойства изделий, определяющие их функциональное назначение, например, прочность, прозрачность, цвет, биологическую совместимость и целостность упаковки. Программа испытаний должна охватить все изменения в производственном процессе, допуски, дозы излучения, источники ионизирующего излучения, сырье и условия хранения. На основании проведенных исследований для каждого изделия устанавливают максимально допустимую дозу излучения.
Действие ионизирующего излучения на материалы может проявляться не сразу после облучения. Поэтому программа испытаний может включать ускоренное старение при экстремальных условиях для первичного анализа материала, а также старение в естественных условиях. Ускоренные испытания могут включать облучение при более высоких дозах, чем необходимо для стерилизации в комбинации с экстремальными условиями хранения. Однако в большинстве случаев частью программы испытаний должно быть испытание в реальном масштабе времени необлученных образцов, хранящихся в нормальных условиях.
При типовых испытаниях может потребоваться облучение изделий или образцов материалов в диапазоне доз от 10 до 100 кГр. Облучение образцов должно проводиться в соответствии с ГОСТ 30392/ГОСТ Р 50325.
Несмотря на то, что изучение старения в естественных условиях нельзя заменить ничем, изучение ускоренного старения может использоваться для подбора материалов. В этом случае используются те же методы испытания, но материалы выдерживают при температуре 60 °С. При отсутствии более точных данных семь дней при 60 °С могут рассматриваться эквивалентными 180 дням старения в естественных условиях окружающей среды. Для ускоренного испытания интервал времени выбирается от одной недели до 30 дней. При естественных условиях окружающей среды интервалы времени выбираются из ряда - 0; 3; 6; 9 и 12 месяцев [1]. Во всех случаях необлученные изделия должны храниться в качестве контрольного образца в течение всего срока годности.
Существует большое количество методов испытаний материалов (таблица А.2). Если материал отбирают на основе этих испытаний, то заключительные испытания, демонстрирующие стабильность функциональных свойств продукции, должны быть выполнены: на полностью обработанных отдельных компонентах или укомплектованных изделиях и упаковочных материалах (готовой продукции). Если выполнялись испытания отдельных компонентов изделия, то на основе испытаний должно быть показано, что они совместимы друг с другом в собранном изделии.
Таблица А.2 - Методы испытания физических и функциональных характеристик для оценки полимерных материалов
| Метод испытания | Ссылка |
| Испытание на хрупкость | |
| 1 Испытания на прочность: | ИСО /Р527-66 |
| а) предел прочности на разрыв; | |
| 2 Испытания на изгиб: | |
| а) испытание на двухопорный ударный изгиб; | "STABILITY OF IRRADIATED POLYPROPYLENE. 1. Mechanical Properties. (Стабильность облученного полипропилена 1. Механические испытания)" Williams, Dunn, Sugg, Stannet. Advances in Chemistry Series, No. 169, Stabilization and Degradation of Polymers, Eds, Allara. Hawkins, pp.142-150, 1978 |
| b) испытание на статический изгиб бруска. | ИСО 178:1975 |
| 3 Прочность на удар | 1985 ASTM Standards Vol. 08.01-Plastics, D-1822-84 |
| 4 Твердость: | |
| а) по Шору | ИСО 868:1985 |
| b) по Роквеллу | 1985 ASTM Standards, Vol. 08.01-Plastics, D-785-65 |
| 5 Сопротивление сжатию | ИСО 604:1973 |
| 6 Прочность на разрыв | 1985 ASTM Standards, Vol. 08.01-Plastics (Tubing), D-1180-57 |
| 7 Износостойкость | 1985 ASTM Standards, Vol. 08.01-Plastics D-1004-66, и ИСО 6383/1-1983 |
| Испытание на изменение цвета | |
| 1 Индекс желтизны | 1985 ASTM Standards, Vol. 08.02-Plastics, D-1925-70 |
| 2 Оптическая спектрометрия | 1985 ASTM Standards, Vol. 08.02-Plastics, D-1746-70 |
| Примечание - Источник - Международное агентство по атомной энергии МАГАТЭ. Руководящие принципы промышленной радиационной стерилизации медицинских продуктов однократного применения. Гамма-излучение Со | |
В дополнение к квалификационным испытаниям физических и механических характеристик материалов может также потребоваться испытание на биологическую совместимость. Изменения в химической структуре полимера и добавок, а также выделение газообразных побочных продуктов во время облучения могут изменять биологическую совместимость материалов, используемых для медицинских изделий. Это испытание должно также демонстрировать биологическую совместимость в течение всего срока годности изделия. В ИСО 10993-1 [2] приведено руководство по выбору основных биологических испытаний, которые могут использоваться для предварительной оценки безопасности облученных материалов, используемых в медицинских изделиях. В зависимости от назначения изделия могут потребоваться специальные испытания.
Строгое соблюдение руководящих принципов, изложенных в настоящем стандарте, поможет первичному изготовителю устранять проблемы при радиационной стерилизации медицинских изделий. Разработчик и первичный изготовитель несут ответственность за обеспечение пригодности материала, изделий и упаковки для облучения. Ответственный за облучения может при необходимости уведомлять об условиях облучения и выполнять облучение испытуемых образцов. Первичные изготовители медицинских изделий также ответственны за обеспечение того, что они информированы поставщиками материалов и компонентов о любых изменениях в рецептуре и технологическом процессе, которые могут влиять на радиационную стойкость.
В таблице А.3 приведен список некоторых типичных материалов с хорошей радиационной стойкостью. Таблица А.4 дает общее руководство по радиационной стойкости материалов.
Таблица А.3 - Примеры радиационно стойких материалов (в диапазоне используемых доз стерилизации)
| Следующие основные материалы, которые доступны на рынке, обладают естественной радиационной стойкостью и могут использоваться в наиболее применяемых стерильных изделиях: |
Таблица А.4 - Общее руководство по радиационной стойкости материалов
| Материалы | Радиационная стабильность | Примечания |
| Термопластичные материалы | ||
| Полистирол | Отличная | - |
| Полиэтилен | Отличная | - |
| Полиамиды | Отличная | - |
| Полиимиды | Отличная | - |
| Полисульфон | Отличная | Натуральный материал - желтый |
| Полифениленсульфид | Отличная | - |
| Поливинилхлорид (ПВХ) | Хорошая | Желтизна - антиоксиданты и стабилизаторы предотвращают пожелтение. |
| Поливинилхлорид-поливинилацетат | Хорошая | Менее устойчив, чем ПВХ |
| Поливинилиденхлорид | Хорошая | Менее устойчив, чем ПВХ |
| Поливинилформаль | Хорошая | Менее устойчив, чем ПВХ |
| Оливинилбутираль | Хорошая | Менее устойчив, чем ПВХ |
| Полистиролакрилонитрил | Хорошая | - |
| Полипропилен | Плохая | Должен быть стабилизирован - физические свойства очень ухудшаются при облучении |
| Фторопласты: | Плохая | При облучении ПТФЭ и ПХТФЭ имеет место значительная деструкция. Другие полимеры показывают лучшую стабильность |
| Целлюлозные: | Плохая | Эфир деструктирует меньше, чем целлюлоза |
| Полиацетали | Плохая | Облучение - причина хрупкости. Были отмечены цветовые изменения (от желтого к зеленому) |
| Термореактивные материалы | ||
| Фенольные | Хорошая | Очень хорошая при добавлении минеральных наполнителей |
| Эпоксидные | Хорошая | Очень хорошая при использовании ароматических отверждающих агентов |
| Полиэфирные | Хорошая | Очень хорошая при добавлении минеральных или стеклянных волокон |
| Аллилдигликолькарбонат (полиэфир) | Отличная | Сохраняет превосходные оптические свойства после облучения |
| Полиуретаны: | ||
| алифатические | Отличная | |
| ароматические | Хорошая | Могут происходить потемнения. Возможно растрескивание изделий |
| Эластомеры | ||
| Уретаны | Отличная | - |
| EPDM | Отличная | - |
| Натуральная резина | Хорошая | - |
| Нитрил | Хорошая | Изменение цвета |
| Полихлоропрен (неопрен) | Хорошая | Изменение цвета - прибавление ароматических пластификаторов делает материал более стабильным к облучению |
| Силикон | Хорошая | Фенилметилсиликон более стабильный, чем метилсиликон |
| Бутадиен-стирол | Хорошая | - |
| Полиакрил | Плохая | - |
| Хлорсульфонат полиэтилена | Плохая | - |
| Примечание - Частичный источник: МАГАТЭ, 1990. | ||
ПРИЛОЖЕНИЕ В (справочное). Методы определения стерилизующей дозы
ПРИЛОЖЕНИЕ В
(справочное)
Примечание - Наряду с методами определения стерилизующей дозы, приведенными в этом приложении, могут использоваться другие методы, которые отвечают требованиям настоящего стандарта. В связи с этим приложение рассматривается как справочное, а термины "должен" и др. рассматриваются только в пределах контекста этого приложения. Если принято решение использовать один из методов определения стерилизующей дозы по настоящему приложению, то требования этого приложения для выбранного метода должны строго соблюдаться.
B.1 Введение
Методы установления дозы, приведенные в этом приложении, во многом используют идеи, выдвинутые первоначально в [12, 13, 14]. Впоследствии были разработаны и стандартизированы методы "возрастающей дозы" [10, 11], которые заложили основу методов определения стерилизующей дозы [4, 6].
Методы используют данные, полученные при инактивации естественной микрофлоры, имеющейся на изделиях. Эти методы основаны на вероятностной модели инактивации микроорганизмов. Вероятностная модель, применяемая к бионагрузке, состоящей из различных разновидностей микроорганизмов, предполагает, что каждая разновидность имеет собственное значение . В этой модели вероятность того, что специфическое изделие будет стерильно после облучения при данной дозе, определена в терминах начального количества организмов на изделии до облучения и значение
.
Методы используют испытание на стерильность продукта или частей продукта, которые получили более низкие дозы радиации, чем стерилизующая доза. После определения стерилизующей дозы необходимо проводить периодические проверки для подтверждения того, что при данной дозе достигается требуемый уровень обеспечения стерильности ().
В.2 Определения
Определения - по 3.8 настоящего стандарта.
В.3 Отбор и испытание продукции
В.3.1 Отбор продукции
Метод отбора единицы продукции для последующего испытания может влиять на результат. Предпочтительно использовать случайный метод. Единицы продукции могут быть выбраны из серийной продукции, которая изготовлена в характерных для данного производства условиях и в которую должны включаться единицы продукции, произведенные в разное время. Если ряд партий изготовлен одновременно, единицы продукции отбирают от каждой партии. Для испытаний могут использоваться забракованные по тем или иным причинам в процессе изготовления единицы продукции при условии, что они прошли полный цикл производства.
В.3.1.1 Часть продукции, отбираемая для испытания в качестве образца ()
Как правило, для испытаний необходимо использовать всю изготовленную продукцию, однако это не всегда возможно. В таких ситуациях можно использовать часть продукции, отбираемую для испытаний в качестве образца. Часть продукции, отбираемая для испытания в качестве образца, должна быть настолько большой, насколько позволяют условия лаборатории. Если невозможно всю часть продукции поместить в одну колбу, можно разделить ее на две или больше колб, а результаты испытаний считать как одно. Если в одной колбе получен положительный результат, то он распространяется на всю часть продукции, отбираемой для испытаний в качестве образца. может быть рассчитана на основе длины, массы, объема или поверхности единицы продукции, которая подвергается испытаниям (см. примеры в таблице В.23).
должна объективно представлять микроорганизмы, подвергаемые процессу стерилизации, и разнообразные элементы сложных изделий. Микроорганизмы в (или на) единице продукции должны быть представлены соответственно отбираемой
. Равномерность бионагрузки единицы продукции должна исследоваться и, если можно показать, что она равномерна,
может отбираться с любого места. При невозможности показать, что бионагрузка распределена равномерно,
должна отбираться случайным образом.
Подготовка и упаковка должна проводиться при условиях минимальной дополнительной бионагрузки. Подготовка
должна осуществляться в помещении с контролируемой окружающей средой и, если возможно, должны использоваться упаковочные материалы, аналогичные используемым для готовой продукции.
Должна демонстрироваться адекватность отбираемой . Бионагрузка
должна быть такой, чтобы испытание на стерильность 20 необлученных образцов дало минимум 17 положительных результатов (т.е. 85% положительных случаев). Если этот критерий не соблюдается, требуется большая
.
Примечание - Если испытывают все изделие целиком, то минимальное количество положительных результатов для необлученных образцов не устанавливают.
Если единица продукции имеет требование по стерильности только внутренней поверхности, по которой течет жидкость, то испытание на стерильность этой поверхности должно рассматриваться как испытание на стерильность целого изделия.
В.3.1.2 Часть продукции, отбираемая для испытаний комплектов
Комплекты, содержащие больше чем одну единицу продукции, рассматриваются как единая медицинская продукция. В состав комплекта могут входить кратные единицы идентичной медицинской продукции (а) или различная медицинская продукция, необходимая для проведения какой-либо одной процедуры или операции (b):
a) Комплекты, содержащие кратное количество одной и той же медицинской продукции. для таких комплектов должна быть основана на предположении, что это одна медицинская продукция, а не сумма всех продуктов в комплекте. Например, для комплекта, содержащего пять шприцев, один проверенный полностью шприц приравнивают к проверке всего комплекта.