ГОСТ Р ИСО 10993.7-99
Группа Р20
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
Оценка биологического действия медицинских изделий
Часть 7
ОСТАТОЧНОЕ СОДЕРЖАНИЕ ЭТИЛЕНОКСИДА ПОСЛЕ СТЕРИЛИЗАЦИИ
Medical devices. Biological evaluation of medical devices. Part 7. Ethylene oxide sterilization residuals
ОКС 01.140.20
ОКСТУ 9403
Дата введения 2002-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 862-ст
3 Настоящий стандарт, за исключением приложения Е, представляет собой аутентичный текст международного стандарта ИСО 10993.7-95 "Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В стандарты серии ГОСТ Р ИСО 10993, имеющие групповой заголовок "Изделия медицинские. Оценка биологического действия медицинских изделий", входят следующие части:
- часть 1 - оценка и исследования;
- часть 3 - исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 - исследование изделий, взаимодействующих с кровью;
- часть 5 - исследование на цитотоксичность: методы in vitro;
- часть 6 - исследование местного действия после имплантации;
- часть 7 - остаточное содержание этиленоксида после стерилизации;
- часть 9 - основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 - исследование раздражающего и сенсибилизирующего действия;
- часть 11 - исследование общетоксического действия;
- часть 12 - приготовление проб и стандартные образцы;
- часть 13 - идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 - моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
Перечисленные стандарты, в том числе настоящий стандарт, носят рекомендательный характер.
Настоящий стандарт обосновывает необходимость проведения контроля содержания остаточных количеств этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) после стерилизации в изделиях медицинского назначения в связи с их токсическим действием в определенных концентрациях. В стандарте обращается особое внимание на биологические реакции, включающие раздражение, повреждение органов, мутагенность и канцерогенность у человека и животных, влияние на репродуктивную функцию у животных.
Методы исследования, изложенные в настоящем стандарте, взяты из международных, национальных стандартов, директив и нормативов.
Допускается применение других методов, обеспечивающих оценку биологического действия медицинских изделий в соответствии с требованиями международных стандартов.
В приложении Е приведена методика определения остаточных количеств в вытяжках из изделий методом газовой хроматографии, применяемая в России при оценке биологического действия медицинских изделий.
Приложения В, Г, Д, Е и Ж носят справочный характер.
1 Область применения
Настоящий стандарт устанавливает допустимые предельные значения для остаточных количеств этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в медицинских изделиях (далее - изделия), стерилизованных ЭО, методы определения ЭО и ЭХГ и требования, в соответствии с которыми осуществляется выпуск изделий.
Требования настоящего стандарта являются рекомендуемыми.
Стандарт не распространяется на изделия, стерилизованные ЭО, но не имеющие контакта с пациентом (например, диагностические устройства, использующиеся in vitro).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты, содержащие положения, которые могут рассматриваться как разделы настоящего стандарта.
ГОСТ 3022-80 Водород технический. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 7568-88 Этилена окись. Технические условия
ГОСТ 15860-84 Баллоны стальные сварные для сжиженных углеводородных газов на давление до 1,6 МПа. Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
ГОСТ Р ИСО 10993.1-99* Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
______________
* На территории Российской Федерации с 01.07.2010 г. действует ГОСТ Р ИСО 10993-1-2009. - Примечание изготовителя базы данных.
ГОСТ Р ИСО 10993.3-99* Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
______________
* На территории Российской Федерации с 01.07.2010 г. действует ГОСТ Р ИСО 10993-3-2009. - Примечание изготовителя базы данных.
ГОСТ Р ИСО 10993.10-99* Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия
______________
* На территории Российской Федерации с 01.09.2010 г. действует ГОСТ Р ИСО 10993-10-2009. - Примечание изготовителя базы данных.
3 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующие определения:
3.1 экстракция, моделирующая условия применения: Экстракция с использованием воды в качестве модельной среды, моделирующая реальные условия применения, выполняемая в соответствии с требованиями настоящего стандарта и позволяющая оценить остаточные количества ЭО и ЭХГ, воздействующие на пациента или пользователя изделий в процессе их применения по назначению.
Примечание - При оценке в аналитической лаборатории основной упор должен быть сделан на то, чтобы данный вид экстракции проводился в условиях, обеспечивающих наибольшее соответствие с предполагаемым способом применения. Моделирование условий применения изделия в медицинской практике должно проводиться с учетом максимально возможного времени воздействия, принимая во внимание температуру воздействия и ткани, контактирующие с данным изделием.
3.2 исчерпывающая экстракция: Экстракция, выполняемая до тех пор, пока количество ЭО и ЭХГ в последующей порции модельной среды не будет составлять менее 10% от определенного при первой экстракции или пока не будет аналитически значимого увеличения в определяемых совокупных остаточных уровнях.
Примечание - Если невозможно показать исчерпывающий характер при оценке остаточных количеств, определение исчерпывающей экстракции принимается в указанном выше виде.
4 Основные требования
Примечание - Информация по источникам ограничений в настоящем стандарте так же, как и другая важная дополнительная информация и руководство к использованию настоящего стандарта содержатся в приложениях.
4.1 Общие положения
В настоящем разделе устанавливают максимально допустимые уровни остаточного содержания ЭО для отдельных изделий, простерилизованных ЭО. Регламентируется также максимальное содержание ЭХГ в случаях, когда его обнаруживают в медицинских изделиях, стерилизованных ЭО.
Для содержания этиленгликоля (ЭГ) никакие ограничения не устанавливают, поскольку оценка степени риска показывает, что, когда остаточные количества ЭО контролируют согласно требованиям настоящего стандарта, маловероятно присутствие биологически значимых остаточных количеств ЭГ (см. Д.1).
Требования, изложенные в настоящем стандарте, являются дополнением к программам биологических исследований, представленным в ГОСТ Р ИСО 10993.1. Для изделий, стерилизованных ОЭ*, следует обратить особое внимание на ГОСТ Р ИСО 10993.3 и ГОСТ Р ИСО 10993.10. При выполнении требований ГОСТ Р ИСО 10993.1 следует учитывать остаточные количества ЭО в момент выпуска продукции для каждого конкретного изделия.
________________
* Текст соответствует оригиналу. - Примечание изготовителя базы данных.
Результаты биологической оценки изделия могут обусловить более жесткие, чем приведенные в 4.3 требования, предназначенные для учета обычных реакций. Например, при биологической оценке раздражающее действие должно рассматриваться для всех изделий, в частности для изделий малого размера (см. Д.2). Настоящий стандарт не учитывает возможности острых локальных реакций, для которых могут быть получены неудовлетворительные данные. Следует обратить внимание на возможность таких реакций особенно для небольших изделий и учитывать концентрацию ЭО на единицу площади поверхности.
4.2 Категории изделий по продолжительности контакта
Для установления максимальной суточной дозы ЭО и ЭХГ, которая может выделяться из изделия и воздействовать на пациента, изделие в зависимости от продолжительности контакта относят к определенной категории.
Согласно ГОСТ Р ИСО 10993.1 изделия однократного, многократного или непрерывного применения по продолжительности контакта относят к одной из трех категорий:
А - изделия кратковременного контакта продолжительностью не более 24 ч;
Б - изделия длительного контакта продолжительностью свыше 24 ч, но не более 30 сут;
В - изделия постоянного контакта продолжительностью свыше 30 сут.
Примечания
1 Если материал или изделие могут быть отнесены более чем к одной категории по продолжительности контакта, следует выбирать более жесткие условия исследований. При многократном применении изделия для принятия решения, к какой категории следует отнести изделие, учитывают возможный кумулятивный эффект, принимая во внимание период времени между повторными применениями.
2 В настоящем стандарте термин "многократное применение" означает применение одного и того же изделия более одного раза.
4.3 Допустимые пределы
Для каждого изделия максимально допустимые дозы ЭО и ЭХГ, которые воздействуют на пациента, не должны превышать значений, приведенных ниже для соответствующей категории.
Примечание - Предельные значения для изделий постоянного и длительного контакта выражаются в максимальной среднесуточной дозе. Для изделий, имеющих постоянный контакт, введены ограничения для первых 24 ч и для первых 30 сут, а для изделий длительного контакта - для первых 24 ч. Эти ограничения устанавливают предельные значения ЭО и ЭХГ, которые могут воздействовать на пациента в ранние периоды времени. Методика, которую использовали для установки допустимых предельных значений, описана в Д.2.
4.3.1 Изделия постоянного контакта
Среднесуточная доза ЭО для пациента должна быть не более 0,1 мг. Дополнительные требования: максимальная доза ЭО должна быть не более:
20 мг - в течение первых 24 ч;
60 мг - в течение первых 30 сут;
2,5 г - в течение жизни.
Среднесуточная доза ЭХГ для пациента должна быть не более 2 мг. Дополнительные требования: максимальная доза ЭХГ должна быть не более:
12 мг - в течение первых 24 ч;
60 мг - в течение первых 30 сут;
50 г - в течение жизни.
4.3.2 Изделия длительного контакта
Среднесуточная доза ЭО для пациента должна быть не более 2 мг. Дополнительные требования: максимальная доза ЭО должна быть не более:
20 мг - в течение первых 24 ч;
60 мг - в течение первых 30 сут.
Среднесуточная доза ЭХГ должна быть не более:
12 мг - в течение первых 24 ч;
60 мг - в течение первых 30 сут.
4.3.3 Изделия кратковременного контакта
Среднесуточная доза ЭО для пациента должна быть не более 20 мг.
Среднесуточная доза ЭХГ для пациента не должна превышать 12 мг.
Примечание - Одновременное использование нескольких изделий или использование изделий для новорожденных может привести к дополнительному воздействию, как указано в Д.2.1.1.
4.3.4 Особые случаи
Для систем, состоящих из нескольких изделий, предельные дозы должны рассчитываться для каждого отдельного изделия.
Остаточное содержание ЭО в интраокулярных линзах должно быть не более 0,5 мкг ЭО на линзу в сутки и 1,25 мкг на линзу.
Для оксигенаторов и сепараторов крови среднесуточная доза ЭО для пациента не должна превышать 60 мг.
Для изделий, предназначенных для экстракорпоральной очистки крови, используют предельные содержания ЭО и ЭХГ, установленные для изделий длительного и кратковременного контакта, но допустимая доза ЭО в течение всей жизни может быть превышена.
Примечание - Рациональный подход для определения предельного содержания ЭО для некоторых изделий, не соответствующих общим требованиям, представлен в Д.2.1.3.
4.4 Определение остаточного содержания ЭО и ЭХГ
Метод определения остаточного содержания ЭО и ЭХГ для проверки соответствия требованиям, изложенным в 4.3, заключается в экстрагировании остаточных количеств из образцов, количественной оценке, анализе и интерпретации полученных данных.
4.4.1 Вопросы безопасности
Аналитики и другие лица, работающие с образцами, должны выполнять все работы, связанные с использованием химических реагентов и растворителей, необходимых для данных методов, под вытяжным шкафом в соответствующей защитной одежде, а перед использованием каждого химического реактива ознакомиться с информацией по безопасности материалов (Material Safety Data).
4.4.1.1 ЭО
Это воспламеняющийся и высокоактивный газ, оказывающий раздражающее действие на поверхности тела. Обладает мутагенным действием, проявляет фетотоксичные и тератогенные свойства и может повреждать многие органы человеческого организма. При изучении канцерогенных свойств ингаляционное воздействие на животных вызывало несколько типов неопластических изменений, включая лейкемию, опухоли мозга и молочной железы, в то время как прием внутрь и внутрикожное введение вызывало опухоли лишь в месте контакта.
4.4.1.2 ЭХГ
Это воспламеняющая жидкость, которая оказывает раздражающее действие на поверхность тела, вызывает острую токсичность и легко всасывается в кожу в количествах, оказывающих токсическое действие. Обладает слабым мутагенным действием, может вызывать фетотоксические и тератогенные изменения, может повреждать различные органы, включая легкие, почки и сердечно-сосудистую систему. Исследования канцерогенности на животных дали отрицательные результаты.
4.4.2 Определение остаточного содержания
Для определения остаточных количеств ЭО и, при необходимости, ЭХГ, воздействующих на пациента, необходимо использовать узаконенные методики экстракции и анализа.
Примечание - Если по результатам анализов, проведенных по методикам, представленным в Б.5.2 и Б.5.7, ЭХГ не обнаружен, в дальнейшем его определение не требуется.
Методики, удовлетворяющие этим требованиям, представлены в приложении Б. Допускается использование любого аналитического метода при условии, что он обоснован, то есть показано, что он удовлетворяет требованиям, изложенным в приложении А, и что он оценен арбитражными методами, представленными в приложении Б.
При выборе пригодных методов экстракции (4.4.6) для количественного определения ЭО или, при необходимости, ЭХГ учитывают дозу, воздействующую на пациента для того, чтобы показать ее соответствие требованиям, приведенным в 4.3.
Если обосновано, что остаточное содержание ЭО и ЭХГ, определяемое методом исчерпывающей экстракции, соответствует требованиям 4,3, экстракцию, моделирующую условия применения в медицинской практике, не проводят. При применении исчерпывающей экстракции обращают особое внимание на предельные значения для первых 24 ч и 30 сут в соответствии с 4.3.
Известно много аналитических методов для определения остаточного содержания ЭО после стерилизации; их обзоры представлены в списке литературы (приложение Ж). Методы, для которых в результате межлабораторного изучения была проведена сравнительная оценка, выполненная высококвалифицированным персоналом с использованием современного оборудования, представлены в приложении Б. Однако большое разнообразие материалов и конструкторских решений при создании медицинских изделий в ряде случаев может вызвать трудности в определении остаточного содержания ЭО и ЭХГ методами, приведенными в приложении Б.
Поэтому любой аналитически значимый метод (т.е. обеспечивающий достоверность, точность, линейность, чувствительность и селективность) может быть использован при условии, что он обоснован. Приложение А содержит общие требования к выполнению методик, а методы, представленные в приложении Б, могут быть использованы как арбитражные для оценки альтернативных методов.
4.4.3 Отбор образцов
4.4.3.1 Представительные образцы
Образцы, которые предназначаются для определения остаточного содержания ЭО и ЭХГ, должны быть отобраны таким образом, чтобы они в достаточной степени отражали свойства изделия в целом. При отборе образцов следует обратить внимание на ряд факторов, указанных в приложении В. Так как многие из этих факторов влияют не только на исходные уровни остаточных веществ во всех компонентах изделия, но и на скорость выделения этих веществ, их также необходимо учесть, начиная с этапа производства и представления в лабораторию для проведения анализа.
Извлечение образцов изделий из обработанной партии сразу после окончания цикла стерилизации и отправка их в лабораторию, находящуюся удаленно от места стерилизации, а также хранение отобранных образцов в лаборатории для последующего анализа могут нарушить корреляцию в содержании остаточных количеств ЭО и ЭХГ в отобранных образцах и в оставшихся в обработанной партии. Более того, если образцы изделий из обработанной партии не могут быть отобраны и доставлены таким образом, чтобы эффект дегазации был незначительным, проводят исследование для установления соответствия дегазации анализируемых образцов и изделий из партии в разное время года.
4.4.3.2 Работа с образцами
Следует контролировать или уменьшить влияние лабораторных условий на скорость дегазации образцов, которые отобраны из партии изделий (см. В.1.5). При проведении анализа соблюдают меры безопасности для оператора и аналитика.
Образцы, предназначенные для анализа, должны оставаться в составе партии вплоть до дня анализа. Время между изъятием образца из зоны контролируемой дегазации и началом экстракции должно быть сведено к минимуму.
Образцы герметично закрывают, перевозят и хранят в замороженном виде, если анализ откладывается. Образцы перевозят обложенными сухим льдом с привлечением службы круглосуточной доставки. Сухой лед оставляют в контейнере для перевозки во время транспортировки и при вскрытии упаковки. В качестве альтернативы образцы для анализа отбирают непосредственно из партии изделий после соответствующей дегазации и сразу помещают в соответствующую жидкость для экстракции или емкость для анализа методом паровоздушной фазы, герметично закрывают и затем перевозят в лабораторию для анализа.
Образцы готовят в соответствии с инструкцией по предварительной подготовке, указанной на этикетке изделия.
Анализируемые образцы помещают в вытяжной шкаф и освобождают от упаковки. Экстракцию следует начинать по возможности быстро после того, как образец извлечен из упаковки или закончена предварительная подготовка.
4.4.3.3 Контрольный образец
Для того чтобы убедиться в отсутствии в веществе, составляющем основу образца, других компонентов со временем удерживания таким же, как и определяемые остаточные продукты, необходимо оценить контрольный образец, не подвергавшийся стерилизации, путем экстракции его с использованием тех же процедур, что и для образцов, стерилизованных ЭО. При наличии материалов, экстрагируемых из такого контрольного образца, для которых времена удерживания совпадают или близки к временам удерживания определяемых веществ, изменяют условия хроматографирования таким образом, чтобы отделить мешающие пики от анализируемого пика, или используют другую аналитическую методику.
4.4.4 Выбор объема модельной среды
Объем модельной среды, используемой для извлечения остаточных количеств определяемых веществ из изделий или их представительных частей, должен быть таким, чтобы обеспечить максимальную эффективность экстракции при достаточной чувствительности определения анализируемых веществ в вытяжке. Таким образом, материал и размер образца изделия обуславливают оптимальный объем модельной среды. Соотношение масса образца/объем модельной среды для различных изделий обычно варьируется от 1:2 до 1:10 (т.е. 1 г в 2 мл и 1 г в 10 мл). Для изделий, изготовленных из материалов с высокими поглотительными свойствами, или для тех, экстракция остаточных количеств из которых проводится методом заполнения, может потребоваться соотношение масса образца/объем модельной среды с большим содержанием последней составляющей. В любом случае, выбор соотношения масса образца/объем модельной среды не должен приводить к уменьшению чувствительности определения.
4.4.5 Время и условия экстракции
Задача экстракции из изделий состоит в извлечении максимального количества вредных веществ, которые могут оказать воздействие на пациента в процессе применения изделия: выход за сутки для изделий кратковременного контакта, выход за сутки и за месяц для изделий длительного контакта, выход за сутки, за месяц и на протяжении жизни для изделий постоянного контакта. Как указано в приложении Д, исчерпывающая экстракция, описанная ниже, является полезным альтернативным методом для оценки изделий постоянного контакта, если учтены ограничения для более короткого периода применения.
4.4.6 Экстракция из изделий
Существуют два основных метода экстракции, которые используют для определения остаточного содержания ЭО после стерилизации: экстракция, моделирующая условия применения в медицинской практике, являющаяся эталонным методом, и исчерпывающая экстракция, которая в ряде случаев является приемлемым альтернативным методом. Выбор метода экстракции должен основываться на предполагаемом способе применения изделия.
В приложении Г приведены примеры предложенных методов экстракции.
Чтобы не занизить реальные величины остаточных количеств веществ, выбранный метод экстракции должен учитывать предполагаемый способ применения изделия с учетом максимального воздействия на пациента.
Температуру и время экстракции выбирают с учетом вида и длительности контакта пациента с изделием в соответствии с 4.2 и 4.3.
4.4.6.1 Экстракция, моделирующая условия применения изделия в медицинской практике (эталонный метод)
4.4.6.1.1 Водная экстракция, моделирующая условия применения, является эталонным методом в том смысле, что это единственный метод, который дает результаты, напрямую сравнимые с предельными содержаниями остаточных количеств веществ в соответствии с требованиями 4.3. Эти предельные содержания выражены в дозах ЭО и ЭХГ, воздействующих на пациента.
Так как необходимо оценить остаточные количества веществ, воздействующие на пациента или пользователя в процессе применения изделия в нормальных условиях, требуются методы экстракции, моделирующие условия применения в медицинской практике. Экстракция, моделирующая условия применения изделия, должна проводиться с учетом максимального приближения к процессу применения.
Например, для многих парентеральных изделий или изделий, контактирующих с кровью, может быть использована экстракция водой или другими водными средами путем заполнения или пропускания модельной среды через те пути, по которым протекает кровь или жидкость, там, где это возможно. Экстракцию из образцов проводят в течение времени, равного или превышающего максимальное время использования при однократном применении (что обеспечивает полную экстракцию) и при температуре, максимально приближенной к реальным условиям применения. Альтернативным способом является приготовление серии вытяжек (не менее трех), охватывающих более короткие промежутки времени, на основе которых определяют скорость экстракции для расчета влияния более длительного или многократного воздействия.
Для определения дозы ЭО и, где необходимо, ЭХГ, воздействующей на пациента или пользователя в течение времени применения изделия, используют метод водной экстракции, моделирующей условия применения. Метод экстракции, моделирующей условия применения, должен быть оценен с точки зрения того, насколько точно он отражает реальные количества веществ, воздействующих на пациента.
Примечание - Количества ЭО (или ЭХГ), выделенные путем экстракции, моделирующей условия применения, необязательно должны совпадать с их общим содержанием в изделии.
Для извлечения остаточных количеств ЭО и ЭХГ методом экстракции, моделирующей условия применения, в качестве модельной среды используют воду и другие водные среды [52]. Эти водные среды используют для извлечения остаточных количеств ЭО, а не для растворения материала самого образца. Если предполагается моделирование применения изделия путем заполнения, его заполняют таким образом, чтобы не было воздушных мешков. Если анализ проводят не сразу, вытяжку сливают в емкость и герметично закрывают крышкой с прокладкой из политетрафторэтилена.
Свободное пространство в емкости с любым раствором или вытяжкой должно составлять менее 10% общего объема. Вытяжку можно хранить в холодильнике в течение нескольких суток (приложение Д), но, если использовали водную экстракцию, следует соблюдать осторожность, так как ЭО может превратиться в этиленгликоль или ЭХГ (или в оба продукта) в процессе хранения вытяжки [18]. Аналитик должен оценить возможность превращения при хранении.
4.4.6.1.2 Исчерпывающая экстракция представляет собой приемлемый альтернативный метод и может дать полезную информацию. Как правило, остаточные количества веществ, полученные этим методом, соответствуют дозе, большей или равной той, которую может получить пациент. Поскольку данный вид экстракции исключает возможность определения дозы в зависимости от времени, он не гарантирует, что масса остаточного количества ЭО не поступит к пациенту в первые 24 ч или 30 сут воздействия. Однако если все допустимые предельные значения согласно 4.3 соблюдаются и показано, что остаточное содержание веществ укладывается в требования для изделий, подвергаемых исчерпывающей экстракции, нет необходимости проводить в дальнейшем экстракцию, моделирующую условия применения. Когда используют исчерпывающую экстракцию, обращают особое внимание на предельные значения, рассчитанные для первых 24 ч и 30 сут согласно 4.3.
4.4.6.2 Исчерпывающая экстракция (приемлемый альтернативный метод)
4.4.6.2.1 Методы исчерпывающей экстракции предназначены для определения полного содержания остаточных веществ в изделии. Для определения ЭО применяют методы экстракции, включающие температурную экстракцию с последующим анализом равновесной паровой фазы, экстракцию растворителем, когда вытяжку анализируют методом равновесной паровой фазы, прямым хроматографированием вытяжки или путем получения бромгидринового производного ЭО, которое определяют с использованием более чувствительного ГХ детектора.
а) Остаточное содержание ЭО
Для определения остаточного содержания ЭО методом исчерпывающей экстракции существует ряд модельных сред. Примером метода, в котором не используют модельную среду, является температурная десорбция с последующим анализом равновесной паровой фазы, как описано в Б.5.3. При проведении анализа подобным образом методы с использованием равновесной паровой фазы считают исчерпывающими, поскольку они предназначены для выделения всех остаточных количеств ЭО в образце. Однако данным методам нельзя отдать предпочтение, или они могут быть вообще невыполнимыми при прямом анализе. Выполняя анализы методом равновесной паровой фазы при определении остаточного содержания ЭО в полимерных материалах, таких как полиметилметакрилат, аналитик должен обратить особое внимание на то, чтобы обеспечить полное выделение ЭО.
Для методов жидкостной экстракции выбор подходящей модельной среды зависит от состава материала изделия и его фрагментов. Чтобы облегчить полное выделение ЭО из образца, в методе исчерпывающей экстракции предпочтение следует отдать жидкостям, которые растворяют материал образца, при условии, что данным методом в раствор не будут внесены мешающие вещества. Методы жидкостной экстракции в сочетании с анализом равновесной паровой фазы описаны в Б.5.4. Такие методы могут оказаться удобными для отделения ЭО от мешающих химических веществ, соэкстрагируемых из вещества, составляющего основу образца. Модельные среды, приведенные в Б.3.2, были оценены в ходе сравнительных межлабораторных исследований [66, 67]. Для того чтобы установить пригодность других модельных сред для метода исчерпывающей экстракции, следует оценить эффективность экстракции по отношению к одному или нескольким методам, изложенным в настоящем стандарте.
Аналитическая методика предписывает в случае использования метода исчерпывающей экстракции при первичном анализе исследуемого образца проводить определение несколько раз, чтобы убедиться в количественном извлечении. Для изделий, содержащих относительно малые количества остаточной ЭО, общепринятые методы могут не обеспечить экстракцию этих количеств даже после относительно продолжительной экстракции.
б) Остаточное содержание ЭХГ
Для экстракции остаточных количеств ЭХГ из изделий обычно используют воду.
4.4.6.2.2 Изделия небольшого размера помещают в емкость для экстракции целиком и проводят экстракцию из всего изделия. Для изделий большого размера, когда необходимо определить остаточное содержание ЭО в части изделия, отбирают представительные фрагменты материалов, входящих в состав изделия. В последнем случае следует соблюдать осторожность. При необходимости, для того, чтобы убедиться в правильности данных, полученных при анализе небольших образцов изделий большого размера, отбирают несколько представительных фрагментов изделия.
Эти представительные фрагменты могут быть отобраны двумя способами. При наличии нескольких разных материалов доля каждого компонента по сравнению с массой образца должна соответствовать доле этого компонента по отношению к общей массе исследуемого изделия. В качестве альтернативы для исследования может быть выбрана часть изделия, если ее оценка показала, что она является наихудшей с точки зрения содержания остаточных продуктов. Выбранный метод должен быть обоснован.
4.4.7 Результаты анализа и их интерпретация
4.4.7.1 Вычисление количества экстрагируемых остаточных веществ
Общее количество экстрагируемых остаточных веществ , мг, рассчитывают исходя из концентрации остаточных веществ, обнаруженных в вытяжках, по формуле
![]() ,
,
где - число экстракций;
- концентрация ЭО, определенная по калибровочной кривой, мг/мл;
- объем вытяжки, мл.
Остаточное содержание при экстракции, моделирующей условия применения изделия, , мл, рассчитывают по формуле
![]() ,
,
где - концентрация ЭО, определенная по калибровочной кривой, мг/мл;
- масса вытяжки, г;
- плотность воды, г/мл.
Остаточное содержание при исчерпывающей экстракции , мл, рассчитывают по формуле
![]() ,
,
где - масса остаточных веществ, экстрагированных из образца, мг;
- общая масса изделия, г;
- масса образца, г.
4.4.7.2 Расчет средней действующей дозы (![]() ) для сравнения с допустимыми значениями, представленными в 4.3
) для сравнения с допустимыми значениями, представленными в 4.3
Для изделий постоянного контакта среднесуточную дозу ![]() рассчитывают по формуле
рассчитывают по формуле
![]() ,
,
где 25000 - продолжительность жизни, сут; - в соответствии с 4.4.7.1.
Для изделий постоянного контакта ![]() также должны соответствовать допустимым значениям, установленным для изделий длительного и кратковременного контакта.
также должны соответствовать допустимым значениям, установленным для изделий длительного и кратковременного контакта.
Для изделий длительного контакта ![]() рассчитывают по формуле
рассчитывают по формуле
![]() ,
,
где 30 - количество суток в месяце; - в соответствии с 4.4.7.1.
Для изделия длительного контакта ![]() также должны соответствовать допустимым значениям, установленным для изделий кратковременного контакта.
также должны соответствовать допустимым значениям, установленным для изделий кратковременного контакта.
Для изделий кратковременного контакта ![]() рассчитывают по формуле
рассчитывают по формуле
![]() ,
,
где - в соответствии с 4.4.7.1.
5 Выпуск продукции
Изделия соответствуют настоящему стандарту, если они отвечают требованиям по содержанию ЭО и, при необходимости, ЭХГ.
Если имеются соответствующие экспериментальные данные по диффузионной кинетике остаточных веществ, изделия для оценки их качества можно сгруппировать по сходству материалов, процессу изготовления и применению (приложение В).
Для выпуска партии стерильных изделий используют один из методов, описанных в 5.1 и 5.2.
5.1 Выпуск продукции без использования данных по кривым дегазации
Когда результаты по кривым дегазации изделий отсутствуют, изделия могут быть выпущены, если они соответствуют настоящему стандарту, а данные, полученные в результате исследований, проведенных по методикам, описанным в приложении Б, соответствуют требованиям по содержанию ЭО и, при необходимости, ЭХГ, установленным в 4.3.
5.2 Методика выпуска продукции с использованием кривых дегазации
Кривые дегазации используют для определения времени после стерилизации, необходимого для того, чтобы содержание остаточных веществ в изделиях или группах однородных изделий достигло значений, особенно в отношении ЭО, соответствующих требованиям 4.3. Изделия должны поставляться на рынок с учетом предварительно установленного времени после окончания стерилизации и условий, определяемых по экспериментальным кривым дегазации так, чтобы остаточные содержания ЭО в изделиях удовлетворяли требованиям 4.3.
Вопросы дегазации продукции, изложенные в приложении В, должны рассматриваться на основе данных о качестве простерилизованных партий, которые хранились в условиях контролируемой дегазации в разные времена года при разных температурах дегазации. Для получения экспериментальных данных при построении кривых дегазации необходимо учитывать наличие других, находящихся рядом, простерилизованных ЭО изделий.
Выпуск изделий, произведенных и простерилизованных в контролируемых условиях в соответствии с ИСО 11135 [1] или EN 550 [2], осуществляют, если собраны данные минимум от трех партий изделий, простерилизованных в разное время. Миграция ЭО из большинства материалов и изделий протекает как кинетическая реакция первого порядка, т.е. ![]() пропорционален времени, прошедшему после стерилизации. График зависимости натурального логарифма экспериментально определенной концентрации ЭО от времени, прошедшего после стерилизации, линеен. Выпуск изделий определяется временем, прошедшим после стерилизации, соответствующим точке пересечения средней линии регрессии со значением максимально допустимого уровня содержания остаточных веществ. Этот подход можно использовать для изделий, которые стерилизуются в количестве (число стерилизуемых партий), недостаточном для использования в ниже описанном методе, или пока собираются данные по кривым дегазации. Использование для построения кривых дегазации регрессионного анализа данных, собранных в результате обработки достаточного числа временных точек по меньшей мере для трех партий изделий, обеспечивает выпуск изделий с допустимым содержанием остаточных веществ на прогнозируемом уровне (
пропорционален времени, прошедшему после стерилизации. График зависимости натурального логарифма экспериментально определенной концентрации ЭО от времени, прошедшего после стерилизации, линеен. Выпуск изделий определяется временем, прошедшим после стерилизации, соответствующим точке пересечения средней линии регрессии со значением максимально допустимого уровня содержания остаточных веществ. Этот подход можно использовать для изделий, которые стерилизуются в количестве (число стерилизуемых партий), недостаточном для использования в ниже описанном методе, или пока собираются данные по кривым дегазации. Использование для построения кривых дегазации регрессионного анализа данных, собранных в результате обработки достаточного числа временных точек по меньшей мере для трех партий изделий, обеспечивает выпуск изделий с допустимым содержанием остаточных веществ на прогнозируемом уровне () с доверительной вероятностью 95%. Кривые время-концентрация для изделий, выполненных из комбинации различных материалов, могут не соответствовать этой простой модели во всей рассматриваемой области и потребовать отдельного рассмотрения.
Прогнозируемый уровень вычисляют по формулам:
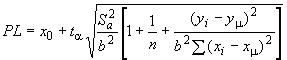 ,
,![]() ,
,
где - расчетное среднее значение времени выпуска изделия, соответствующее допустимому содержанию ЭО, ч;
- значение логарифма допустимого содержания ЭО;
- отрезок прямой линейной регрессии;
- угол наклона линии регрессии;
- прогнозируемое предельное значение для одной единицы изделия;
- величина коэффициента Стьюдента при доверительной вероятности
с
![]() степенями свободы;
степенями свободы; - дисперсия линии регрессии для остаточных веществ;
- среднее значение логарифма ЭО;
- число измеряемых величин;
- время, прошедшее с момента стерилизации, при котором были произведены измерения;
- среднее время, прошедшее с момента стерилизации.
Все данные, используемые для выпуска изделий в соответствии с настоящим стандартом, должны быть получены в процессе экспериментов и анализов, выполненных по стандартизованным методикам.
При изменении условий стерилизации, перечисленных в приложении В, следует провести проверку содержания остаточных веществ в изделии. Если эта проверка показывает увеличение уровня остаточного содержания ЭО, чтобы убедиться в пригодности изделий, следует получить новые кривые дегазации остаточных веществ.
ПРИЛОЖЕНИЕ А (обязательное). Оценка хроматограмм, полученных методом газовой хроматографии
ПРИЛОЖЕНИЕ А
(обязательное)
А.1 Общие положения
В настоящем приложении устанавливается минимальный набор требований при выполнении аналитических методик, используемых для определения ЭО и ЭХГ.
А.2 Источники
Эти требования приведены в справочниках по газовой хроматографии [106] и перед выполнением какой-либо методики должны быть проанализированы аналитиком. Рекомендуется также просмотреть статьи, касающиеся пределов обнаружения [12], [18], [39].
А.3 Обозначения
В настоящем приложении используют следующие обозначения: - разрешение;
- фактор образования "хвоста" пика;
,
- время удерживания хроматографических пиков 1 и 2, где
соответствует пику ЭО (или ЭХГ), а
- время удерживания ближайшего соседнего пика (рисунок А.1);
,
- соответствующая ширина пиков, экстраполированная к базовой линии для пиков 1 и 2, выраженная в тех же единицах, что и время удерживания (рисунок А.1);
- ширина пика на уровне 5% высоты (рисунок А.2);
- расстояние от максимума пика до начала фронта пика (рисунок А.2);
- фактор емкости;
- время выхода компонентов, не удерживающихся на колонке, таких как воздух (рисунок А.1);
- время удерживания основного пика определяемого остаточного вещества (ЭО или ЭХГ);
- высота пика.
Рисунок А.1 - Хроматографическое разделение двух веществ
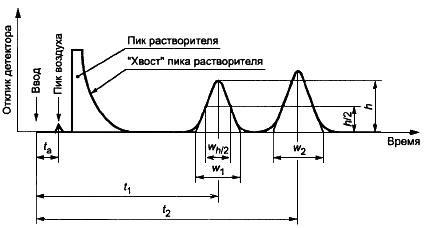
Рисунок А.1 - Хроматографическое разделение двух веществ
Рисунок А.2 - Асимметричный хроматографический пик
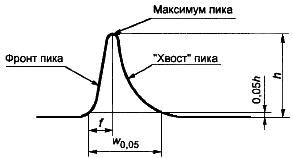
Направление движения диаграммы
Рисунок А.2 - Асимметричный хроматографический пик
А.4 Минимальные требования
А.4.1 Для выполнения методик рекомендуется, чтобы параметры отвечали следующим минимальным требованиям.
Разрешение рассчитывают по формуле
![]() .
.
Значение разрешения при расчете по площади или высоте пика должно быть больше или равно 1,2.
Альтернативно фактор емкости рассчитывают по формуле
![]() .
.
Значение фактора емкости должно быть больше или равно 1,5.
Фактор образования "хвоста" пика рассчитывают по формуле
![]() .
.
Значение "хвоста" пика должно быть меньше или равно 1,5.
При количественной оценке низких концентраций ЭО или ЭХГ отношение сигнал-шум должно быть по меньшей мере 10:1 (для определения соотношения сигнал-шум может оказаться необходимым установить аттенюацию усилителя газового хроматографа 1х1).
Для вычисления разрешения и фактора образования "хвоста" пика скорость самописца должна быть не менее 10 см/мин, а высота пика должна составлять не менее 75% от полного размаха шкалы.
А.4.2 Номинальное относительное отклонение калибровочного графика () должно быть меньше или равно 5% для ЭО и ЭХГ для ряда используемых растворов стандартных образцов
![]() ,
,
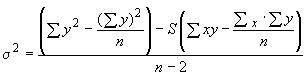 ,*
,*
________________
* Формула соответствует оригиналу. - Примечание изготовителя базы данных.
![]() ,
,
где - число измерений;
- площадь или высота хроматографического пика;
- концентрация раствора стандартного образца;
- наклон линии регрессии для калибровочного графика, рассчитанный по методу наименьших квадратов;
- среднее значение;
- стандартное отклонение;
- дисперсия.
Эти критерии рассчитаны при многократных анализах по крайней мере трех эталонных образцов, приготовленных таким образом, чтобы они охватывали всю линейную область калибровочного графика, используемого в анализе ЭО и ЭХГ.
А.5 Базовая линия хроматограммы
Рекомендуется, чтобы между отдельными хроматографическими измерениями базовая линия возвращалась на уровень, не превышающий 5% от первоначальной базовой линии.
А.6 Дополнительные источники информации
Когда необходимо внести изменения в аналитические методики, изложенные выше, рекомендуют использовать следующие источники информации: руководство по эксплуатации используемого газового хроматографа, различные учебники по газовой хроматографии.
ПРИЛОЖЕНИЕ Б (обязательное). Газохроматографическое определение ЭО и ЭХГ
ПРИЛОЖЕНИЕ Б
(обязательное)
Б.1 Хроматографические методики
Б.1.1 Методы определения остаточного содержания ЭО
Для количественного определения ЭО в вытяжках используют различные методы. В научной литературе описан ряд методик проведения исчерпывающей экстракции с последующим определением ЭО методом газовой хроматографии. В приложении Ж даны ссылки на несколько опубликованных методов, а также на ряд обзорных статей. Возможно, также существует ряд неопубликованных методов для определения остаточного содержания ЭО. Опубликованные методы не всегда могут оказаться подходящими в связи с разнообразием изделий. Поэтому допускается использовать любой метод, являющийся аналитическим и оцененный в сравнении с утвержденными методами, изложенными в настоящем стандарте.
Метод является аналитическим, когда он обладает соответствующими точностью, селективностью, линейностью и чувствительностью, достаточными для определения уровня содержания этиленоксида в изделиях, который предназначен для анализа на соответствие предельным значениям остаточных количеств, установленным в 4.3, и применим к анализируемому изделию.
Методы, изложенные в настоящем приложении, являются арбитражными методами, по отношению к которым должен оцениваться любой альтернативный метод.
В настоящем приложении методы представлены таким образом, чтобы аналитик мог выбрать наиболее приемлемый. Для более детального обсуждения каждого метода следует обращаться к оригинальной литературе. Аналитики должны установить стабильность растворов стандартных образцов, используемых для калибровки в хроматографических методиках, и убедиться, что не используются растворы стандартных образцов с просроченным сроком годности.
Б.1.2 Подготовка растворов стандартных образцов ЭО
Б.1.2.1 Общие положения
В следующих пунктах изложены в общих чертах методики приготовления растворов стандартных образцов для газовой хроматографии.
Примечание - Альтернативой является приобретение стандартных образцов, стабильность которых гарантирована, изготовленных под контролем Good Manufacturing Practices.
Готовят растворы стандартных образцов либо объемным методом при растворении известных объемов газообразной ЭО, либо гравиметрически, растворяя жидкую ЭО известной массы. В обоих случаях строят стандартный калибровочный график зависимости высоты или площади пика от концентрации ЭО.
Соединяют баллон, содержащий ЭО с нормированными характеристиками, с флаконом объемом приблизительно 30 мл, снабженным пробкой, как показано на рисунке Б.1, для чего трубкой связывают регулятор баллона с иглой для инъекций. Протыкают входной иглой 1 пробку флакона и опускают ее конец вниз до дна.
Рисунок Б.1 - Устройство для приготовления стандартов ЭО
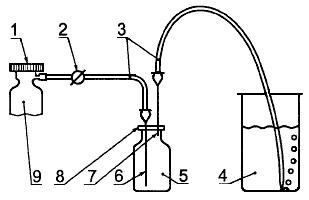
1 - клапан; 2 - регулятор; 3 - трубки ПВХ; 4 - стакан с водой; 5 - флакон; 6 - входная игла 1; 7 - выходная игла 2; 8 - завинчивающаяся крышка с ПТЭФ прокладкой; 9 - баллон с газообразным ЭО
Рисунок Б.1 - Устройство для приготовления стандартов ЭО
Внимание! Крайне важно для защиты аналитика от вредного действия проводить данную процедуру в вытяжном шкафу (см. 4.4.1).
Прокалывают пробку флакона второй иглой для инъекций так, чтобы кончик иглы находился в верхней части флакона. Присоединяют трубку с выходной игле 2 и опускают конец трубки в стакан с водой объемом 300 мл.
Начинают пропускать ЭО через систему таким образом, чтобы пузырьки вытесняемого газа выходили из трубки со скоростью один пузырек в секунду. Продувают сосуд в течение приблизительно 15 мин. Удаляют входную иглу 1 из флакона и уравновешивают давление газообразной ЭО в сосуде с атмосферным, что достигается удалением выходной иглы 2, как только исчезнут пузырьки в стакане с водой. В приближении к закону для идеальных газов можно показать, что концентрация ЭО во флаконе составит 1,83 мкг/мл при давлении 760 мм рт.ст.* и температуре 20 °С.
________________
* 1 мм рт.ст. =133,322 Па; 760 мм рт.ст. =101,325 кПа.
Концентрация этиленоксида в микрограммах на миллилитр, согласно закону для идеальных газов, может быть рассчитана для конкретной температуры в градусах Цельсия и давления
, мм рт.ст., по формуле
![]() ,
,
где 0,706 - значение, обратное газовой постоянной для определения ЭО, г·К·мм рт.ст.
·л
.
Б.1.2.2 Разбавления стандартных образцов ЭО для анализа методом равновесной паровой фазы
Разбавляют стандартный образец, приготовленный согласно Б.1.2.1, во флаконе (номинальный объем 15 мл). Объем флакона должен быть предварительно определен с погрешностью до 0,01 мл (при анализе образцов необходимо использовать флаконы такой же вместимости). Сначала во флакон пропускают сухой азот в течение 1 мин. Из флакона с газообразной ЭО отбирают около 10 мкл с помощью газового шприца. Удаляют шприц из флакона и поршнем шприца получают желаемый объем в положении с поднятой вверх иглой.
Помещают флакон, заполненный азотом, на конец направленной вверх иглы и вводят 10 мкл ЭО во флакон. Не прокачивая шприц, немедленно удаляют его из флакона. Теперь флакон содержит 18,3 мкг ЭО при температуре 20 °С и давлении 760 мм рт.ст. Уравновешивают концентрацию ЭО с окружающими условиями, как описано в Б.1.2.1.
Вводят пробу газа 100 мкл из флакона в газовый хроматограф для получения хроматограммы. Анализ повторяют дважды. Приготавливают более высококонцентрированные стандартные образцы путем разбавления больших аликвот чистой газообразной ЭО. Так как во флаконах содержится свободная газообразная ЭО, растворы стандартных образцов не нужно нагревать в отличие от других образцов.
Б.1.2.3 Разбавления стандартных образцов ЭО для методов с участием растворителя
Примечания
1 Удобнее переносить жидкую ЭО с помощью предварительно охлажденного шприца. Следует принять меры предосторожности, чтобы игла шприца не касалась растворителя.
2 Опыт показал, что ошибки измерения, связанные с приготовлением основных растворов, постоянны и не зависят от объема приготовленного раствора. Относительная ошибка будет меньше, если приготовить и использовать большие объемы.
3 Данную методику используют также и для приготовления водных растворов стандартных образцов ЭО.
Устанавливают баллон, содержащий газообразную ЭО с нормированными характеристиками, как описано в Б.1.2.1, соединив его с флаконом, предварительно продутым, как описано выше, и помещенным в баню со смесью сухого льда с изопропанолом или аналогичную, чтобы сконденсировать газообразную ЭО в жидкость. К флакону через иглу для инъекций присоединяют только трубку, по которой поступает ЭО из баллона. Нет необходимости вставлять выходную иглу 2, так как ЭО собирают в жидком виде.
Заполняют флакон нужным объемом жидкой ЭО, перекрывают регулятор на баллоне и удаляют входную иглу 1 с трубкой. Достают флакон из бани со льдом.
Взвешивают герметично закрытую мерную колбу объемом 100 мл (с пробкой с покрытием из ПТФЭ), содержащую 60 мл растворителя, с погрешностью 0,1 мг. Добавляют в колбу пять капель жидкой ЭО и вновь взвешивают. Заполняют колбу растворителем до отметки 100 мл, переворачивают и перемешивают*.
________________
* Растворы стандартных образцов наиболее устойчивы, если мерную колбу хранят в перевернутом положении. Это необходимо учесть, если растворы стандартных образцов хранят в течение некоторого времени.
Готовят ряд разбавленных растворов, смешивая аликвоты стандартного образца с подходящим объемом растворителя. Если, например, точно 100 мг ЭО было добавлено к 100 мл растворителя, конечная концентрация будет составлять 1 мг/мл. Разбавляя 1 мл этого раствора до 10 мл, получают раствор стандартного образца с содержанием ЭО 100 мкг/мл. Таким же способом готовят растворы стандартных образцов с более высокой и более низкой концентрацией ЭО. Готовят растворы стандартных образцов таким образом, чтобы они охватывали всю область ожидаемых количеств ЭО в анализируемом образце.
Вводят от 1 до 5 мкл аликвот каждого раствора стандартного образца в колонку хроматографа для получения значения площади или высоты пика. Определение повторяют дважды.
Опыт практической газовой хроматографии показывает, что при введении образцов в колонку газового хроматографа точность ввода улучшается при увеличении вводимого объема образца. Относительная ошибка, связанная с неточностью калибровки шприца, уменьшается при увеличении вводимого объема. Для повышения точности объем вводимой пробы должен составлять не менее 10% от объема шприца.
Б.1.3 Приготовление растворов стандартных образцов ЭХГ
Взвешивают мерную колбу объемом 100 мл, содержащую 60 мл воды, с погрешностью 0,1 мг. По каплям добавляют ЭХГ (около 100 мг). Вновь взвешивают колбу. Если растворы стандартных образцов хранят в течение некоторого времени, определяют разницу в массах; затем доводят объем до метки водой и перемешивают. Если растворы стандартных образцов используют не сразу, их хранят в холодильнике (см. приложение Д). После 14 сут хранения растворы стандартных образцов подлежат уничтожению.
Доводят растворы стандартных образцов ЭХГ до комнатной температуры. Готовят как минимум три рабочих раствора различной концентрации. До использования растворов стандартных образцов для построения калибровочного графика проверяют линейность параметров хроматографического пика в этих областях концентраций. Готовят растворы стандартных образцов таким образом, чтобы они охватывали всю область ожидаемых содержаний ЭХГ в анализируемом образце. Для определения значения площади или высоты пика вводят аликвоты каждого раствора стандартного образца от 1 до 5 мкл в колонку хроматографа. Определение повторяют дважды.
Б.2 Точность методов
Б.2.1 Методы определения ЭО
Межлабораторная оценка ряда методов определения ЭО, изложенных в приложении Б [66]-[68], была проведена с использованием серий образцов, содержащих ЭО от 40 до 350 мг/кг. Вычисленный общий коэффициент вариации изложенных методов представлен в таблице Б.1.
Таблица Б.1 - Сравнение коэффициентов вариации при внутри- и межлабораторном изучении методов
В процентах
Определение ЭО | Межлабораторное изучение | Внутрилабораторное изучение |
Метод равновесного пара | 3,7 | 21,3 |
Метод с использованием ацетона | 4,1 | 16,3 |
Метод с использованием DMF | 2,9 | 8,3 |
Метод с использованием воды | 2,7 | 17,0 |
При другом межлабораторном изучении проведена оценка метода определения ЭО, изложенного в Б.5.6 [51]. Данные линейной регрессии были получены при сравнении результатов двух лабораторий для серий образцов, содержащих ЭО от 3,6 до 26 мг/кг. Рассчитанное уравнение регрессии ![]() ; коэффициент корреляции
; коэффициент корреляции =0,974 (
<0,00001). Рассчитанный коэффициент вариации метода при межлабораторном изучении составлял 4,0% при содержании ЭО в анализируемой матрице 14 мг/кг или 8,3% при содержании ЭО 30 мг/кг (неопубликованные данные, представленные A.Nakamura, H.Kikuchi и K.Tsuji).
В двух лабораториях были получены данные анализа образцов с тремя различными содержаниями ЭО с использованием как метода экстракции растворителем с последующим анализом равновесной паровой фазы, изложенного в Б.5.4 [81], так и метода бромирования, изложенного в Б.5.6 [51]. Результаты сравнивали, используя линейный регрессионный анализ. Были получены следующие характеристики регрессии: ![]() ; коэффициент корреляции
; коэффициент корреляции =0,999. При межлабораторном изучении методики, представленной в Б.5.4, коэффициент вариации составлял 4,7; 1,8 и 2,7% при содержании ЭО в анализируемой матрице 12,25* и 56 мг/кг соответственно [77].
_______________
* Текст соответствует оригиналу. - Примечание изготовителя базы данных.
Б.2.2 Методы определения ЭХГ
Межлабораторную оценку проводили, используя методы определения ЭХГ, изложенные в разделе Б.5.7 [9]. Вычисленный коэффициент вариации был следующим:
7,46% - при внутрилабораторном изучении;
10,99% - при межлабораторном изучении.
Эти данные были получены для концентраций ЭХГ от 3,0 до 100 мкг/мл.
Б.3 Оборудование и реагенты
Б.3.1 Оборудование
Б.3.1.1 Газовый хроматограф, оснащенный пламенно-ионизационным детектором (FID) или детектором электронного захвата (ECD).
Примечание - Для получения воспроизводимых результатов предпочтительно использовать электронный интегратор.
Б.3.1.2 Инъекционные иглы и трубки из поливинилхлорида, необходимые для приготовления стандартных образцов.
Б.3.1.3 Мерная стеклянная посуда, снабженная пробками, покрытыми ПТФЭ, или прокладками из ПТФЭ, для приготовления стандартных образцов.
Примечания
1 Для стеклянной посуды с закатываемыми крышками необходим инструмент для закатки.
2 Следует соблюдать меры предосторожности при выборе стеклянной посуды подходящей вместимости с тем, чтобы уменьшить пространство, занятое равновесным паром, над раствором вытяжки или раствором стандартного образца. При приготовлении жидких растворов стандартных образцов или вытяжек пространство, занятое равновесным паром, должно быть менее или равно 10% от объема вытяжки или раствора стандартного образца.
Б.3.1.4 Микрошприц (объемом 5 или 10 мкл) для ввода аликвот вытяжки в газовый хроматограф.
Б.3.1.5 Вытяжной шкаф для обеспечения соответствующей вентиляции при приготовлении стандартных и других образцов.
Б.3.1.6 Аналитические весы, обеспечивающие взвешивание с погрешностью до 0,1 мг.
Б.3.1.7 Газовый регулятор для емкости, содержащей ЭО.
Б.3.1.8 Газонепроницаемые шприцы объемом 10, 50, 100 и 1000 мкл для приготовления растворов стандартных образцов и ввода равновесной паровой фазы в колонку газового хроматографа.
Б.3.1.9 Лабораторный термошкаф для нагревания образцов до температуры (100±2) °С.
Б.3.1.10 Лабораторный термошкаф для нагревания образцов до температуры (37±1) °С.
Б.3.1.11 Водяная баня для термостатирования образцов при температуре (70±2) °С.
Б.3.1.12 Механический встряхиватель
Б.3.1.13 Стеклянные емкости для проведения анализа методом равновесного пара, снабженные прокладками с покрытием из ПТФЭ и закатанными крышками, с номинальным объемом 20 мл для приготовления стандартных образцов при построении калибровочного графика.
Примечание - Для стеклянной посуды с закатываемыми крышками необходим инструмент для закатки.
Б.3.1.14 Емкость с плоским дном и завинчивающейся крышкой объемом 4 мл (15 мм в диаметре), снабженная силиконовой прокладкой с покрытием из ПТФЭ и тонкой пленкой из ПТФЭ, которую используют для экстракции и получения производных ЭО.
Б.3.1.15 Игла для ввода бромистоводородной кислоты диаметром 0,65 мм и длиной 24 мм.
Б.3.1.16 Фильтр фирмы "Миллипор"* с порами размером 45 мкм для фильтрации реакционной смеси перед хроматографическим определением.
________________
* "Миллипор" - торговая марка продукта. Данная информация приведена только для удобства пользователей настоящего стандарта, она не является характеристикой качества изделий со стороны ИСО. Можно использовать аналогичные изделия, если показано, что результаты от этого не изменяются.
Б.3.1.17 Холодильная камера для хранения образцов при температуре от 2 до 8 °С.
Б.3.2 Реагенты
Б.3.2.1 Эпоксиэтан (этилен оксид) в подходящем газовом баллоне; содержание основного вещества - 99,7%.
Б.3.2.2 2-Хлорэтанол (этиленхлоргидрин); содержание основного вещества 99%.
Б.3.2.3 1,2-Эпоксипропан (пропиленоксид), реактив.
Б.3.2.4 Свежеперегнанную (дважды) бромистоводородную кислоту готовят следующим образом.
Перегоняют 100 мл 47%-ной бромистоводородной кислоты в присутствии 100 мг хлорида олова (II). Первые 25 мл дистиллята отбрасывают, а следующие 50 мл собирают. Вновь перегоняют 50 мл дистиллята в присутствии 50 мг хлорида олова (II), отбрасывают первые 15 мл дистиллята и собирают следующие 20 мл бесцветной жидкости (температура кипения от 125 до 126 °С). Хранят в стеклянном контейнере со стеклянной пробкой и используют в течение недели.
Б.3.2.5 Хлорид олова (II), реактив.
Б.3.2.6 Вода, пригодная для газовой хроматографии по степени чистоты.
Б.3.2.7 Этиловый спирт, пригодный для газовой хроматографии по степени чистоты.
Б.3.2.8 Пропанон (ацетон), пригодный для газовой хроматографии по степени чистоты.
Б.3.2.9 Диметилформамид (ДМФА), пригодный для газовой хроматографии по степени чистоты.
Б.4 Приготовление растворов стандартных образцов
Б.4.1 Приготовление растворов стандартных образцов ЭО
Соответствующие растворы стандартных образцов готовят методом, изложенным в Б.1.2.
Б.4.2 Приготовление растворов стандартных образцов ЭХГ
Растворы стандартных образцов ЭХГ готовят методом, изложенным в Б.1.3.
Б.4.3 Приготовление растворов стандартных образцов пропиленоксида (ПО)
Готовят растворы стандартных образцов растворением ПО в этиловом спирте таким образом, чтобы получить раствор концентрацией 0,5 мкг/мл.
Б.5 Экстракция из изделий
Б.5.1 Общие положения
Готовят вытяжки в соответствии с указаниями, представленными в 4.4.6.
Б.5.2 Экстракция, моделирующая условия применения изделия
Для моделирования условий применения изделия в медицинской практике применяют воду. Осуществляют экстракцию в условиях, наиболее приближенных к тем, в которых применяют изделие.
Например, выполняют экстрагирование из изделий, контактирующих с кровью, и парентеральных изделий водой или другими жидкостями путем их полного заполнения или пропуская модельную среду по тем путям, по которым протекает кровь или жидкость (подходит любой метод).
Примечание - При полном заполнении необходимо убедиться, что отсутствуют пустоты.
Когда невозможно заполнить составные части изделия, контактирующие с пациентом или пользователем, помещают все изделие или исследуемый фрагмент изделия в подходящий контейнер, соблюдая нужное соотношение образец/модельная среда. Чтобы убедиться в достоверности данных, полученных при анализе небольших образцов или изделий большего размера, отбирают несколько представительных фрагментов изделия.
Образцы подвергают экстракции в течение времени, равного или превышающего наибольшее время контакта изделия с пациентом при однократном применении. Выбирают температуру экстракции в соответствии с 4.4.6. В качестве альтернативного метода готовят серию вытяжек (рекомендуется как минимум три), соответствующих нескольким более коротким периодам времени, и используют скорость экстракции для вычисления влияния при более длительном или многократном воздействии.
Если анализ не проводят сразу, декантируют вытяжку во флакон и хранят, закрыв пробкой с прокладкой, покрытой ПТФЭ. Пространство, занятое равновесным паром, во флаконе с раствором стандартного образца или вытяжкой должно быть менее 10% от общего объема. Вытяжка может храниться в холодильной камере до 4 сут. Когда для определения ЭО и ЭХГ используют водные вытяжки, соблюдают меры предосторожности, так как в процессе хранения водной вытяжки [18] ЭО может превратиться в ЭГ или ЭХГ, или в оба этих продукта.
Б.5.3 Методика исчерпывающей экстракции при повышенной температуре
Взвешивают 1 г образца с погрешностью 0,1 мг и помещают его во флакон объемом 15 мл с самоуплотняющейся мембраной и закатанной крышкой. Помещают герметично закрытый флакон в термошкаф, нагретый до 100 °С, и термостатируют в течение 60 мин. Вынимают флакон из термошкафа, доводят до комнатной температуры и энергично перемешивают до отбора пробы. Вводят 100 мкл пробы равновесной паровой фазы в колонку хроматографа (анализ повторяют дважды) и определяют высоты и площади пиков соответствующих ЭО. Рассчитывают среднее для двух измерений.
Используя вытяжной шкаф, удаляют крышку с флакона и продувают его в течение 30 с сухим азотом. Используя новую мембрану, снова закатывают крышку и повторяют нагревание и ввод пробы до полного извлечения ЭО. Полное извлечение достигается, когда экстрагируемое количество ЭО составляет менее 10% от полученного при первой экстракции. С использованием калибровочного графика рассчитывают количество ЭО в образце, суммируя количества ЭО, полученные для средних значений измерений площадей или высот пиков при каждом из нескольких нагреваний образца.
Примечания
1 Выбор режима время/температура, описанного в Б.5.3, относительно произволен. Более пригодной экспериментальной методикой является изменение времени для достижения равновесия парциального давления ЭО с паровой фазой. Будьте осторожны. При введении пробы игла не должна соприкасаться с наполнителем колонки. Опыт показал, что анализ горячих образцов сразу после того, как они были удалены из термошкафа, часто приводит к ошибке более 20% из-за потери материала в шприце, так как при удалении шприца из флакона давление в шприце уравновешивается с атмосферным давлением. Некоторые материалы ресорбируют ЭО во время уравновешивания их температуры с комнатной. Существуют также некоторые материалы, которые полностью ресорбируют ЭО при охлаждении. При проведении анализа таких материалов может оказаться необходимым вводить исследуемые образцы и растворы стандартных образцов в колонку хроматографа, пока они еще горячие или теплые, а затем прокачать шприц без дальнейшего охлаждения.
2 Рабочая группа 11 ИСО/ТК 194 изучала автоматизированные методики анализа равновесной паровой фазы с точки зрения их включения в будущие издания настоящего стандарта.
Б.5.4 Исчерпывающая экстракция этиловым спиртом с последующим анализом этанольных вытяжек методом равновесной паровой фазы
Б.5.4.1 Растворы стандартных образцов для построения калибровочного графика
Готовят растворы стандартных образцов, разбавляя ЭО в этиловом спирте таким образом, чтобы получить растворы с концентрацией ЭО 0,4; 0,8; 1,2; 1,6 и 2 мкг/мл. Готовят раствор стандартного образца ПО в этиловом спирте с концентрацией 0,5 мкг/мл в соответствии с Б.4.3. Охлаждают эти растворы и соответствующее число специальных флаконов для анализа методом равновесной паровой фазы (рисунок Б.2) в бане, заполненной смесью сухого льда с изопропанолом или аналогичным образом. Переносят соответствующие аликвоты каждого раствора стандартного образца ЭО и те же самые объемы раствора стандартного образца ПО во флаконы для проведения анализа методом равновесной паровой фазы. Термостатируют флаконы при температуре 70 °С в течение 30 мин и вводят от 100 мкл до 1 мл аликвот равновесной паровой фазы из каждого флакона в колонку газового хроматографа (анализ проводят дважды). Чтобы получить калибровочный график, измеряют высоты или площади пиков ЭО и ПО и строят зависимость отношения высот или площадей пиков от концентрации ЭО.
Рисунок Б.2 - Специальный флакон для проведения анализа методом равновесной паровой фазы
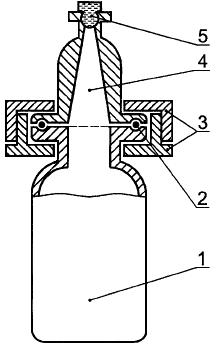
1 - жидкость; 2 - О-образное кольцо; 3 - зажим; 4 - равновесная паровая фаза; 5 - самоуплотняющаяся мембрана
Рисунок Б.2 - Специальный флакон для проведения анализа методом равновесной паровой фазы
Б.5.4.2 Методика анализа
Взвешивают 5 (или 0,5) г исследуемого образца, разрезанного на небольшие кусочки (длиной 5 мм для трубок, площадью 10 мм для пластин) с погрешностью до 0,1 мг и помещают во флакон объемом 100 (или 10) мл для проведения анализа методом равновесной паровой фазы. Добавляют во флакон 50 (или 5) мл раствора стандартного образца ПО (0,25 мкг/мл). Закрывают флакон, закатывают крышку и термостатируют герметично закрытый флакон при температуре 70 °С в течение 3 ч с легким встряхиванием. Вводят от 100 мкл до 1 мл равновесной паровой фазы в колонку газового хроматографа и определяют отношения параметров пиков ЭО/ПО (определение повторяют дважды). Используя калибровочный график, вычисляют среднее содержание ЭО для двух параллельных образцов.
Б.5.5 Исчерпывающая экстракция с использованием растворителя
Взвешивают около 1 г образца изделия и помещают в мерную стеклянную посуду с крышкой такой вместимости, чтобы объем равновесной паровой фазы был минимален. С помощью пипетки добавляют в мерную колбу 10 мл выбранного растворителя. Закрывают колбу и оставляют при комнатной температуре на 24 ч.
Примечание - Эти температуры и время использовались при сравнительном изучении. Можно использовать другие время и температуры, если выбор обоснован.
Вводят аликвоты от 1 до 5 мкл в колонку хроматографа (анализ повторяют дважды). Вычисляют содержание ЭО в образцах, используя калибровочный график, и рассчитывают среднее для двух анализов.
Б.5.6 Исчерпывающая экстракция этиловым спиртом с последующим получением бромгидринового производного и газохроматографическим определением с использованием ECD
Б.5.6.1 Растворы стандартных образцов для построения калибровочного графика
Готовят растворы стандартных образцов, растворяя ЭО в этиловом спирте, чтобы получить растворы, содержащие ЭО в концентрациях 0,4; 0,8; 1,2; 1,6 и 2 мкг/мл. Готовят раствор стандартного образца, содержащий ПО в этиловом спирте с концентрацией 0,5 мкг/мл, в соответствии с Б.4.3. Готовят стандартные смеси, смешивая равные объемы каждого раствора стандартного образца ЭО и стандартного образца ПО.
Переносят 1 мл каждой смеси во флакон с завинчивающейся крышкой*. Добавляют 2 капли (0,015 г) бромистоводородной кислоты к смеси через мембрану с помощью инъекционной иглы. Оставляют флакон при комнатной температуре на 1 ч. Нагревают флакон в течение 1 ч при температуре 50 °С на водяной бане с легким перемешиванием, затем охлаждают до комнатной температуры.
________________
* Использование емкостей с U- или V-образной формой дна иногда вызывает неполную нейтрализацию, что приводит к плохим хроматограммам.
Добавляют 0,02 г бикарбоната натрия во флакон и перемешивают путем встряхивания в вертикальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин. Встряхивают флакон в горизонтальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин, а затем центрифугируют с частотой вращения 3000 об/мин в течение 5 мин. Фильтруют смесь через фильтр "Миллипор"*.
________________
* Использование емкостей с U- или V-образной формой дна иногда вызывает неполную нейтрализацию, что приводит к плохим хроматограммам.
Чтобы получить значения отношений высоты пика этиленбромгидрина (ЭБГ) и пропиленбромгидрина (ПБГ), вводят 1 мкл аликвоты каждого фильтрата в колонку газового хроматографа (определение повторяют дважды). Строят калибровочный график - зависимость отношения высот пиков ЭБГ/ПБГ от количества ЭО в микрограммах.
Б.5.6.2 Методика анализа
Используют данную методику с растворами стандартных образцов, приготовленными в соответствии с Б.5.6.1.
Охлаждают раствор стандартного образца ПО (0,25 мкг/мл) и флакон с завинчивающейся крышкой в бане со смесью сухой лед/изопропиловый спирт или аналогичным образом. Переносят 1 мл раствора стандартного образца ПО во флакон*.
________________
* Использование емкостей с U- или V-образной формой дна иногда вызывает неполную нейтрализацию, что приводит к плохим хроматограммам.
Взвешивают от 10 до 30 мг исследуемого образца с погрешностью до 0,1 мг и помещают его во флакон.
Добавляют две капли (0,015 г) бромистоводородной кислоты во флакон через мембрану с помощью инъекционной иглы. Оставляют флакон при комнатной температуре на 1 ч, а затем нагревают его на водяной бане при температуре 50 °С в течение 8 ч с легким перемешиванием и дополнительно еще в течение 16 ч при температуре 50 °С в термошкафу, а затем охлаждают до комнатной температуры.
Добавляют 0,02 г бикарбоната натрия во флакон и встряхивают флакон в вертикальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин. Снова встряхивают флакон в горизонтальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин, а затем центрифугируют при частоте вращения 3000 об/мин в течение 5 мин. Фильтруют смесь через маленький фильтр "Миллипор"*.
________________
* "Миллипор" - торговая марка продукта. Данная информация приведена только для удобства пользователей настоящего стандарта, она не является характеристикой качества изделий со стороны ИСО. Можно использовать аналогичные изделия, если показано, что результаты от этого не изменяются.
Чтобы получить значения отношения высоты пика ЭБГ к высоте пика ПБГ, вводят 1 мкл аликвоты каждого фильтрата в колонку газового хроматографа (определение повторяют дважды).
Вычисляют среднее значение параллельных определений и определяют содержание ЭО в образце, используя калибровочный график.
Б.5.7 Исчерпывающая экстракция этиленхлоргидрина с использованием воды
Взвешивают от 1 до 50 г фрагмента образца (или целый образец) и помещают в стеклянную посуду такой вместимости, чтобы объем равновесной паровой фазы был минимален. Вводят воду, исходя из соотношения от 1:2 и 1:10 (отношение массы образца в граммах к объему воды в миллилитрах) в контейнер и закрывают. Оставляют стоять на 24 ч при комнатной температуре. Энергично перемешивают контейнер с содержимым на механической мешалке приблизительно 10 мин*.
________________
* Данные время и температуру использовали при сравнительной оценке [9]. Они могут быть заменены другими подходящими временем и температурами. При необходимости перемешивание осуществляют в течение всего времени. Для некоторых материалов перемешивание не потребуется.
Вводят от 1 до 5 мкл пробы в колонку газового хроматографа. Рассчитывают концентрацию ЭХГ в образце по относительной площади пика или высоте пика, используя предварительно построенный калибровочный график.
Б.6 Газовая хроматография
Б.6.1 Общие положения
Выбирают наиболее пригодный метод из приведенных в Б.5.2-Б.5.7. Используют подходящую аналитическую методику из тех, что представлены в таблице Б.2.
Примечание - Может потребоваться оптимизация условий.
Таблица Б.2 - Рекомендуемые условия газохроматографического определения
Колонка | Газ-носитель | Температура, °С | ||||||||
Усло- | Размер: длина (м) | Мате- | Фаза | Наиме- | Ско- | Термо- | Инжек- | Детек- | Объем пробы, мкл | Раство- |
I | 2х2 | Стекло | 3% Карбовакса | Азот или гелий | 20-40 | 60-75 (ЭО) 150-170 (ЭХГ) | 200-210 | 220-250 | 1,0-5,0 | Вода |
II | 2х2 | Стекло | 5% Игепала | Азот или гелий | 20-40 | 140-160 | 200-250 | 240-280 | 1,0-5,0 | Вода |
III | 3х3,2 | Нержа- | 20% Трициано- | Азот или | 20 | 60 | 100 | 200 | 1000 | Равно- |
IV | 2х3 | Стекло | 25% Флексола | Азот | 40 | 50 | 120 | 120 | 100-1000 | Равно- |
V | 2х2 | Стекло | Хромосорб 102 | Азот или гелий | 20-40 | 60-170 | 200-210 | 220-250 | 1,0-5,0 | Пропанон или ДМФ |
VI | 2х3 | Стекло | 10% Карбовакса | Азот | 60 | 120 | 250 | 250 | 1,0 | Этанол |
________________
| ||||||||||
Б.6.2 Экстракция, моделирующая условия применения изделия
Для определения ЭО используют условия газохроматографического определения I с температурой термостата колонок от 60 до 75 °С; для определения ЭХГ используют условия I (см. таблицу Б.2) с температурой термостата колонок от 150 до 170 °С или условия II. Вводят аликвоты водной вытяжки от 1 до 5 мкл.
Б.6.3 Методика исчерпывающей экстракции при повышенной температуре
Используют условия газохроматографического определения I с температурой термостата около 125 °С. Вводят аликвоты равновесной паровой фазы 100 мкл.
Б.6.4 Исчерпывающая экстракция этиловым спиртом с последующим анализом методом равновесной паровой фазы этанольной вытяжки
Используют условия IV.
Б.6.5 Исчерпывающая экстракция этиловым спиртом с последующим приготовлением бромгидринового производного и определением методом газовой хроматографии с детектором ECD
Используют условия VI.
ПРИЛОЖЕНИЕ В (справочное). Факторы, влияющие на содержание остаточных веществ в изделии
ПРИЛОЖЕНИЕ В
(справочное)
B.1 Параметры процесса стерилизации
Параметры определены в ИСО 11135 или EN 550. Однако, касаясь определения содержания остаточных веществ в изделиях, обработанных ЭО, необходимо выяснить, какие именно параметры влияют на уровень содержания остаточных веществ. Понимание кинетики миграции ЭО позволяет охарактеризовать целое семейство однотипных изделий, анализируя "наихудший" образец. Выделение семейства однотипных изделий, то есть изделий, сходных по размеру и применению, составу материала, упаковке, содержанию воды, подвергавшихся воздействию ЭО и окружающих условий, может исключить необходимость проведения анализа изделий каждого вида. Ниже приведены параметры, которые влияют на содержание остаточных веществ и могут потребовать проведения анализа одного или более "наихудших" представительных образцов.
B.1.1 Состав материала
Материалы могут различаться в значительной степени по своей способности абсорбировать, удерживать и десорбировать ЭО. Когда возможно превращение ЭО в ЭХГ, появляется вероятность, что состав остаточных веществ будет весьма различен для двух сходных изделий, изготовленных из различных материалов. Например, материалы, содержащие источник свободных хлорид-ионов, дают большой разброс в концентрации образующегося ЭХГ.
Аналогично, чтобы убедиться в достоверности результатов анализа целого изделия, в состав которого входят два различных материала, может потребоваться проведение анализа представительных образцов обоих материалов. Состав и размер исследуемого образца играют особенно важную роль, когда рассматривается модель, отражающая условия применения изделий в медицинской практике.
В.1.2 Упаковка
Упаковочные материалы сильно отличаются по своей способности пропускать и удерживать как ЭО, так и другие возможные остаточные вещества, что может в свою очередь влиять на остаточное содержание ЭХГ. Дополнительные источники разброса - плотность упаковки и плотность загрузки грузовых контейнеров.
В.1.3 Цикл стерилизации ЭО
Условия процесса обработки изделия ЭО влияют на содержание остаточных веществ. Эти условия включают в себя концентрацию газа, время обработки, температуру, вид обработки (то есть, используется ли чистая ЭО или смесь, содержащая ЭО), влажность (включая качество источника воды), воздушную продувку, плотность самих изделий и плотность их загрузки при стерилизации, а также расположение партии изделий в стерилизаторе.
В.1.4 Дегазация
Остаточное содержание ЭО в изделиях также зависит от температуры дегазации, плотности и расположения партии изделий при дегазации, воздушного потока, площади поверхности изделий, которые подвергаются дегазации, и времени дегазации. Для ряда материалов известно, что при увеличении температуры на каждые 10 °С скорость дегазации может увеличиться почти вдвое (время дегазации уменьшается наполовину).
Примечания
1 Влажность, температура и воздушный поток могут повлиять на образование ЭХГ, зависящее от содержания ЭО в изделии после удаления из стерилизатора.
2 Аналитики должны иметь информацию о сезонных колебаниях в скорости дегазации, о лабораторных условиях хранения образцов, которые отличаются от условий хранения на складе. При определенных обстоятельствах, которые лучше всего могут быть определены опытным путем, может оказаться необходимым до начала анализа держать образцы при температуре, близкой к наименьшей температуре, при которой хранились изделия во время дегазации.
В.1.5 Отбор образца
При оценке результатов анализа в следующих случаях соблюдают осторожность:
- когда образцы изделий постоянно отбираются для анализа из стерилизуемой партии вскоре после окончания процесса стерилизации;
- когда образцы изделий или вытяжек из них переносятся на место анализа, расположенное удаленно от места стерилизации.
В таких случаях возникает возможность появления ошибок, связанных с распространением результатов определения количества остаточных веществ в образцах на всю партию. Следует экспериментально установить связь между этими условиями.
В.2 Контроль переменных величин
При наличии достаточных экспериментальных данных по диффузионной кинетике остаточных веществ (то есть по скорости улетучивания газообразной ЭО из упаковки для ряда конкретных изделий) изделия могут быть сгруппированы для оценки их качества на основании сходства материалов, процессов производства и применения. Чтобы такая система классификации была действенна, необходимо контролировать переменные условия, рассмотренные выше. Недостаточность контроля может привести к тому, что данные анализа уровней остаточных веществ окажутся применимы лишь к анализируемым образцам.
ПРИЛОЖЕНИЕ Г (справочное). Условия экстракции для определения остаточного содержания ЭО
ПРИЛОЖЕНИЕ Г
(справочное)
Условия экстракции для определения остаточного содержания ЭО изложены в 4.4. Рекомендуемые условия экстракции, которые могут облегчить лабораторные операции, представлены в таблице Г.1. Определения понятий исчерпывающей экстракции и экстракции, моделирующей условия применения, даны в 4.4.6.
Таблица Г.1 - Предлагаемые условия экстракции
Продолжительность контакта с изделием (см. 4.3) | ||
Постоянный контакт | Длительный контакт | Кратковременный контакт |
Исчерпывающая экстракция | Экстракция, моделирующая условия применения | |
Основным принципом при выборе подходящего метода экстракции для определения ЭО является оценка воздействующей на пациента дозы для того, чтобы показать соответствие этой дозы требованиям настоящего стандарта, применяя там, где можно, методы, моделирующие применение изделия. Изделия, относящиеся к категории длительного контакта, должны удовлетворять требованиям к изделиям кратковременного контакта, а изделия, относящиеся к категории постоянного контакта, должны удовлетворять требованиям к изделиям длительного и кратковременного контакта, независимо от того, какой способ экстракции используют. Если показано, что содержание остаточных веществ удовлетворяет требованиям для изделий, анализируемых методом исчерпывающей экстракции, нет необходимости проводить дальнейшую оценку изделий методом экстракции, моделирующей условия применения.
ПРИЛОЖЕНИЕ Д (справочное). Логическое обоснование введения предельных значений
ПРИЛОЖЕНИЕ Д
(справочное)
Д.1 Область применения [раздел 1]
Настоящее приложение содержит пояснения к введению предельных значений остаточного содержания ЭО в изделиях после стерилизации в зависимости от продолжительности контакта. Сюда также включено обоснование введения предельных значений для ЭО и ЭХГ. Для ЭГ не требуется вводить максимальное допустимое предельное значение остаточного содержания в изделиях. Если остаточное содержание ЭО контролируется до установленных здесь предельных значений, маловероятно, что в изделии останется биологически значимое количество ЭГ [22], [76], [101].
Для ряда изделий, которые в процессе применения не достигают этих предельных значений, может быть разрешена большая, безвредная для пациента, доза. К таким изделиям относятся экстракорпоральные устройства для очистки крови, для которых максимальная суточная доза ЭО не должна превышать 20 мг, максимальная месячная доза ЭО не должна превышать 60 мг, но максимальная доза на протяжении всей жизни может превысить 2,5 г, оксигенаторы крови и сепараторы крови, для которых максимальная суточная доза и максимальная месячная доза не должна превышать 60 мг, а максимальная доза ЭО на протяжении всей жизни не должна превышать 2,5 г (см. 4.3).
Д.2 Допустимые предельные значения [4.3]
Д.2.1 Определение предельных значений остаточного содержания ЭО
Д.2.1.1 Основы метода
Предельные значения остаточного содержания ЭО в медицинских изделиях были установлены с использованием методов, предложенных Американской ассоциацией производителей фармацевтической продукции [85]. Эти методы применяют для определения предельных значений остаточного содержания летучих органических примесей в фармацевтических препаратах постоянного применения. Особое внимание было уделено данным по парентеральным и оральным лекарственным формам, так как эти данные более близки к возможному воздействию ЭО на организм при применении медицинских изделий, чем данные по ингаляционным формам. Методика определения остаточных количеств ЭО была модифицирована таким образом, чтобы ее можно было использовать для оценки действия на организм при кратковременном контакте (менее 24 ч) и при длительном контакте (от 24 ч до 30 сут) [19]. Данный подход требует, чтобы при определении предельных значений оценивались все полученные результаты. Этот подход базировался на концепции, в соответствии с которой для определения предельных значений должны быть получены данные: для определения предельных значений при кратковременном контакте - результаты изучения острой токсичности, для определения предельных значений при длительном контакте - результаты изучения подострой токсичности и влияния на репродуктивную функцию, а для изделий постоянного контакта - результаты изучения хронической токсичности и данных по канцерогенности. В случае, когда результаты по острой токсичности не позволяли получить необходимую информацию по воздействию дозы (кроме средних летальных доз) для обоснования объективности предельных значений остаточных веществ, полученных на основе данных по острой токсичности, использовали результаты по токсичности, полученные при изучении подострой токсичности и влияния на репродуктивную функцию.
Для определения предельных значений, воздействующих на организм, использовали коэффициенты безопасности, представленные в таблице Д.1, которые менялись в зависимости от продолжительности воздействия. Для определения порога безопасности рассматривают также экстраполяцию полученных на животных данных на человека, качество исследования, в результате которого были рассчитаны предельные значения, применение этих предельных значений для лиц с низкой массой тела и моделирование применения нескольких изделий на одном индивидууме. Отдельно каждый из этих коэффициентов не задается какими-либо определенными параметрами.
Примечание - Эти коэффициенты установлены для настоящего стандарта во время его утверждения. Технический комитет ИСО/ТК 194 признает, что ко времени следующего пересмотра стандарта при получении новых данных эти коэффициенты могут быть изменены.
Таблица Д.1 - Перечень коэффициентов безопасности, используемых для определения предельных значений для ЭО
Предельное значение остаточных количеств | Вид исследования | Доза | Коэффициент безопасности |
Постоянное воздействие | Хроническая токсичность (лечение/воздействие более 12 мес) | NOEL или NOAEL | 10 |
LOEL или LOAEL | |||
Карциногенез | NOEL или NOAEL | 100 | |
LOEL или LOAEL |
| ||
Длительное воздействие | Подострая токсичность (лечение/воздействие до 6 мес) | NOEL или NOAEL | 100 |
LOEL или LOAEL |
| ||
Токсическое воздействие на репродуктивную функцию/хроническая токсичность | NOEL или NOAEL | 100 | |
LOEL или LOAEL |
| ||
Кратковременное воздействие | Острая токсичность | LD | >100 |
LDL |
| ||
TDL | >1 или >10 | ||
| |||
Предельное значение с использованием коэффициентов безопасности вычисляют по формуле
![]() ,
,
где доза , мг·кг
·сут
, может быть одной из следующих:
NOEL - не оказывающая воздействия;
LOEL - оказывающая минимальное воздействие;
NOAEL - при которой не наблюдается вредного воздействия;
LOAEL - при которой наблюдается минимальное вредное воздействие;
LD - средняя летальная;
LDL - минимальная летальная;
TDL - минимальная токсичная;
- масса тела человека, в кг;
- порог безопасности, равный коэффициенту безопасности, умноженному на модифицирующий коэффициент.
Так как ЭО генотоксична и вызывала опухоли у животных в нескольких исследованиях, рядом согласительных групп и координирующих организаций во всем мире рассматривается вопрос о канцерогенности ее для человека. Для установления предельных значений остаточного содержания ЭО при постоянном воздействии использовали статистическую количественную оценку данных с точки зрения риска возникновения рака. Так как оценка риска возникновения рака под воздействием ЭО была выполнена многими группами, данные расчетов использовали для вычисления предельного значения остаточного содержания ЭО, которое представляет собой агравированную суточную дозу ЭО на протяжении всей жизни, связанную с превышением риска возникновения рака 1 на 10000 обследуемых, как предложено Ассоциацией производителей фармацевтических препаратов, для ЭО как летучей органической примеси в фармацевтических препаратах постоянного использования [86]. Уровень риска 10 является средним уровнем среди рекомендуемых или используемых различными координирующими организациями. Он учитывает риск при использовании стерильных жизненно важных изделий. В самом деле, общество обычно считает допустимым некоторое увеличение риска, когда речь идет об изделиях, применение которых приносит пользу для здоровья. Без стерильных изделий станет невозможным использование процедур и оборудования, спасающих жизнь, и возрастет риск, связанный с внутрибольничными инфекциями.
Предельные значения содержания ЭО в изделиях были установлены на основе рассмотрения ряда данных и нескольких обзоров [16], [21], [26], [29] и [86]. Поскольку возможное воздействие медицинских изделий, стерилизованных ЭО, оценивается при биологических исследованиях, данные по острой токсичности, действию на органы-мишени, по карциногенезу у животных и по толерантности у человека считают наиболее подходящими для определения предельных значений остаточного содержания ЭО в изделии в целях предотвращения возможных вредных эффектов от воздействия ЭО. Дополнительно при оценке потенциальной токсичности ЭО, как обсуждается ниже, следует обратить внимание на моделирование условий применения нескольких изделий одновременно и применение изделий при лечении новорожденных ([26], ГОСТ Р ИСО 10993.1, подраздел 6.1 б) 5).
Д.2.1.2 Общее рассмотрение
Данные по острой токсичности и результаты, полученные при многократном введении доз показывают, что сразу же после введения ЭО легко включается в общий обмен в организме. Анализ данных по средним летальным дозам (LD) и дозам, не оказывающим действия (NOEL), также позволяет сделать вывод, что действие ЭО в определенные интервалы времени, т.е. при ограниченном воздействии и т.д., сопоставимо при оральном, парентеральном и даже ингаляционном способах введения. Когда увеличивается продолжительность времени воздействия, неблагоприятные явления наблюдают при меньших дозах. Однако специфическое действие на органы-мишени может различаться. Предельные допустимые суточные дозы, которые обсуждаются в последующих разделах, отражают эти общие наблюдения.
Д.2.1.2.1 Предельное значение при постоянном воздействии
Предельное значение при воздействии от 30 сут и на протяжении всей жизни составляет 0,1 мг/сут, оно не должно превышать 20 мг для отдельно взятых суток, или 60 мг в месяц, либо 2500 мг на протяжении всей жизни. Эти предельные значения получены на основе данных по хронической токсичности и канцерогенности, которые приводятся многими исследователями [24], [99], [62], [63], [80]. Все исследования, кроме описанного Дункельбергом [24], проводились с использованием ингаляционного введения. Приемлемых данных при парентеральном введении не найдено.
В исследовании Дункельберга изучаемую пробу вводили животным орально с помощью одноразовых шприцов, снабженных трубками для введения пробы в желудок, то есть использовали желудочные зонды. Дозы увеличивались, начиная с 2,1 мг·кг·сут
. В исследовании вредное воздействие на органы-мишени в хроническом эксперименте выражалось в снижении функции спермы, атрофии скелетных мышц и предраковых повреждениях желудка, причем было найдено несколько видов раковых повреждений, включающих мононуклеарную клеточную лейкемию, первичные опухоли мозга, перитонеальные мезотелиомы, подкожные фибромы, аденомы/карциномы легких, железисто-папиллярные цистоденомы Гардериана, лимфомы, аденокарциномы молочной железы и матки, а также плоскоклеточные карциномы пищевода. При оральном введении были обнаружены только опухоли желудка. При ингаляционном введении найдены другие изменения. Эти данные оценивали, используя как коэффициент безопасности, так и статистическую количественную методику оценки риска. Несмотря на оценку ЭО как генотоксичного канцерогена, основанную на ее возможном мутагенном действии и возникновении у животных некоторых видов опухолей, присущих и человеку, недостаток данных по биологическому воздействию ЭО на животных и человека, а также отсутствие ясной эпидемиологии, связывающей воздействие ЭО и возникновение рака у человека, препятствует тому, чтобы считать, что статистическая количественная методика оценки риска является единственным средством для расчета предельных значений при постоянном воздействии ЭО. Поэтому для определения прогнозируемых предельных значений при постоянном воздействии применяют как подход, основанный на использовании коэффициента безопасности, так и количественную оценку риска. Сравнение результатов, полученных двумя способами, послужило основой для определения предельных значений при постоянном воздействии [86], [19]).
Результирующие данные, которые явились основой для расчета прогнозируемых предельных значений при постоянном воздействии с использованием коэффициентов безопасности, представлены в таблице Д.2.
Таблица Д.2 - Результирующие данные, использованные для определения предельных значений для ЭО при постоянном воздействии
Тип данных | Доза LOEL орально | Доза LOEL ингаляционно |
мг·кг | ||
Хроническая токсичность | 2,1 - значение, рассчитанное, исходя из введения 7,5 мг/кг дважды в неделю [24] | 9,2 |
Канцерогенность | 2,1 | |
| ||
Анализ этих данных показывает, что дозы LDL для ЭО при постоянном воздействии, то есть от 30 сут и на протяжении всей жизни сравнимы и не зависят от способа введения, несмотря на отсутствие достоверных данных, которые позволили бы оценить влияние при парентеральном введении.
Когда в качестве ответной реакции ткани рассматривается возникновение рака, дозу, оказывающую минимальное воздействие LOEL, выраженную в миллиграммах на килограмм в сутки, рассчитанную исходя из дозы 2,1 мг/кг при оральном введении крысам в течение трех лет, используют в качестве основы для расчета прогнозируемого предельного значения для постоянного воздействия с применением коэффициента безопасности.
, мг/сут, рассчитывают по формуле
![]() ,
,
где - доза, оказывающая минимальное воздействие при изучении хронической токсичности или канцерогенеза, мг·кг
·сут
;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 1000, для экстраполяции данных по дозе, оказывающей минимальное воздействие на человека при биологических исследованиях рака. Порог безопасности учитывает возможность межвидовых различий, изменчивость, присущую человеческой популяции, природу, область локализации и масштабы наблюдаемых изменений, отсутствие парентеральных данных, отсутствие установленного уровня, при котором эффекта в соответствующем исследовании не наблюдается, и пользу, которую дает применение стерильных изделий.
Количественная оценка риска была взята из опубликованных данных. Как указывает Энвирон [26], оценки риска возникновения рака для ЭО были рассчитаны многочисленными группами исследователей. Чтобы получить оценки единицы риска возникновения рака, эти группы, включающие FDA, California DHS, OSHA и USEPA, применяли линеаризированные многоступенчатые модели или линейно-пропорциональные методы Гайлора-Коделля, используя опубликованные данные по лейкемии, опухолям мозга, опухолям желудка и мезотелиоме, полученные при исследовании на животных. Эти оценки единицы риска возникновения рака варьируют между 0,016 и 0,35 мг·кг·сут. Усредняя эти значения, получим агравированные суточные дозы на протяжении жизни взрослого человека массой 70 кг в случае, когда риск возникновения рака превышает 1 на 10000, в диапазоне 0,02-0,44 мг/сут со средним значением 0,12 мг/сут. Расчет средней дозы
, мг/сут, с использованием единицы риска возникновения рака 0,016 мг
·кг·сут проводят по формуле
![]() ,
,
где - превышение риска возникновения рака 1/10000;
- масса тела взрослого человека 70 кг;
- единица риска возникновения рака, мг
·кг·сут.
На основе оценки прогнозируемого предельного значения 0,15 мг/сут и средней агравированной дозы 0,12 мг/сут, вызывающей превышение риска возникновения рака 1 на 10000, было установлено, что доза 0,1 мг/сут будет достаточной для предотвращения вредного воздействия ЭО, возникающего при постоянном применении изделий. Предельное значение при постоянном воздействии учитывает возможное действие в течение очень широкого периода времени от 30 до 25000 сут при продолжительности жизни в 70 лет. Таким образом, в наихудшем случае подлинный риск возникновения рака при воздействии ЭО на уровне, задаваемом этим предельным значением, во многих случаях может быть намного меньше чем 1 на 10000, так как это предельное значение предполагает ежедневное воздействие ЭО в течение 70 лет. Изучение применения медицинских изделий, стерилизованных ЭО, позволило сделать вывод, что реальная вероятность возникновения рака при воздействии ЭО из изделий низка (около семи случаев на миллион) [26].
Д.2.1.2.2 Предельное значение при длительном воздействии
Предельное значение для воздействия длительностью от 24 ч до 30 сут составляет 2 мг/сут и не превышает 20 мг в любые отдельно взятые сутки или 60 мг в месяц. В основе этого предельного значения лежат данные по подострой токсичности и влиянию на репродуктивную функцию (тератогенность, характеристика репродуктивности, фетотоксичность и т.д.), полученные на нескольких биологических видах. Эти данные приводятся многими исследователями [38], [109], [11], [78], [98], [80], [41], [45], [54], [33], [96], [97].
В ходе исследований разной продолжительности вплоть до 226 сут при оральном, парентеральном и ингаляционном введении проявились многообразные вредные последствия от воздействия ЭО, в том числе рвота, треморы, раздражение дыхательных путей, повреждение легких, почек, надпочечников, тимуса, печени и желудочно-кишечного тракта, снижение массы тела и замедление роста, ухудшение функций нервной системы, паралич и атрофия мышц (задних конечностей) и анемия. Дозы варьировались от 1 до 100 мг/кг и более. Изучение влияния на репродуктивную функцию включало в себя воздействие на животных в течение 12 недель до оплодотворения, воздействие в период всего или части времени беременности и воздействие в течение 21 сут после родов. Дозы варьировались от 5 до 150 мг/кг или более. В этих исследованиях ЭО оказывала токсическое действие на материнский организм, эмбриотоксическое и фетотоксическое действие, замедляла эмбриональное развитие и вызывала пороки развития шейно-грудного отдела скелета. Этот последний эффект наблюдался только в потомстве мышей, которым вводили ЭО внутривенно в дозе 150 мг/кг, что составляет две трети от LD ЭО, равной 260 мг/кг, для самок мышей. Результирующие данные, на основе которых проводили расчет предельных значений при длительном воздействии, представлены в таблице Д.3.
Таблица Д.3 - Результирующие данные, использованные для определения предельных значений ЭО при длительном воздействии
Тип исследования | Доза NOEL, орально | Доза NOEL, парентерально | Доза NOEL, ингаляционно |
мг·кг | |||
Подострая токсичность | 30 [38] | 25 [78] | 5 |
Токсическое действие на репродуктивную функцию | Нет данных | 9 [45] | 13 |
| |||
Анализ данных, полученных при оральном и парентеральном введениях, позволяет прийти к выводу, что не оказывающие действия дозы ЭО для периодов длительного воздействия, то есть от 1 до 30 сут, сравнимы, независимо от того, является ли это действием на специфический орган-мищень или на репродуктивную функцию, и не зависят от способа введения. Данные, полученные при ингаляционном введении, приводят к аналогичному результату, хотя рассчитанное значение дозы NOEL оказывается меньшей, чем доза NOEL, полученная из данных при оральном и парентеральном введении. Доза NOEL, полученная при изучении подострой токсичности при ингаляционном введении, оказывается низкой, что обусловлено частично теми концентрациями, которые использовались в исследовании. При следующей большей по значению концентрации 50 мг/кг, как сообщали исследователи, вредное действие проявлялось только в снижении локомоторной функции, сгорбленной позе при ходьбе и снижении массы яичек. Поскольку данные, полученные при оральном и парентеральном введении, оказались наиболее применимыми к медицинским изделиям, за основу при расчете предельных значений при длительном воздействии была взята наименьшая доза NOEL при парентеральном введении, которая составляла 9 мг/кг при внутривенном тератологическом исследовании, проведенном на кроликах. Расчет , мг/сут, проводили по формуле
![]() ,
,
где - доза, не оказывающая действия, при изучении подострой токсичности или влияния на репродуктивную функцию при парентеральном введении, мг·кг
·сут
;
- масса тела женщины 58 кг, так как выбранные данные являлись результатом тератологического изучения беременных животных;
- порог безопасности, равный 250 (коэффициент безопасности, равный 100, умноженный на модифицирующий коэффициент, равный 2,5), для экстраполяции данных по дозе, не оказывающей воздействия, полученных на животных и отражающих межвидовые различия реакции.
Таким образом, предельное значение, основанное на данных, полученных в исследованиях на животных, обеспечивает приемлемый порог безопасности для возможных вредных эффектов, связанных с длительным воздействием ЭО на взрослого человека массой 58 кг.
Д.2.1.2.3 Предельные значения при кратковременном воздействии
Предельное значение при продолжительности воздействия менее 24 ч составляет 20 мг. Предельное значение установлено на основании данных по острой токсичности, полученных для нескольких видов животных. Эти данные приведены многими исследователями [17], [16], [41], [109], [92]. Хотя существует ограниченное количество данных по LDL или TDL
[86], использовались данные по LD
, так как они были единственными, пригодными для оценки. При отсутствии данных по LD
включали три значения дозы LDL
в области от 100 до 200 мг/кг. Данные по влиянию значения дозы были получены при изучении острой токсичности на мышах при ингаляционном введении [80]. В этом исследовании 9 из 10 мышей погибли после введения ЭО в концентрации 800 мг/кг (
) в течение 4 ч, в то время как после введения ЭО в концентрации 400 мг/кг (
) не погибло ни одной мыши из 10. Таким образом, как показывают данные исследований, дозы которые, вызывают биологическое действие в остром эксперименте, а также летальные и нелетальные дозы, близки друг к другу и отличаются менее чем в два раза. Данные по дозам LD
представлены в таблице Д.4.
Таблица Д.4 - Результирующие данные, использованные для определения предельных значений для ЭО при кратковременном воздействии
В миллиграммах на килограмм
Орально LD | Внутривенно LD | Внутрижелудочно LD | Подкожно LD | Ингаляционно LD |
Крыса: 72 | Кролик: 175 | Крыса: 150 | Мышь: 130 | От 155 до 773 (рассчитано) |
Крыса: 240 | Кролик: 178 | Мышь: 175 | Крыса: 140 | |
Морская свинка: 270 | Кролик: 180 | Мышь: 178 | Крыса: 187 | |
Крыса: 280 | Мышь: 260 | Крыса: 178 | Мышь: 190 | |
Мышь: 280 | Мышь: 290 | Крыса: 180 | Кролик: 200 | |
Крыса: 330 | Крыса: 350 | Мышь: 180 | Мышь: 250 | |
Мышь: 360 | Крыса: 355 | Кролик: 251 | ||
Кролик: 631 | Крыса: 380 | |||
| ||||
Анализ этих данных позволяет сделать вывод, что токсичность ЭО при кратковременном воздействии, то есть за период, меньший 24 ч, может различаться примерно в три раза и не зависит от способа введения. Так как эти данные отражают средние летальные дозы, а не минимальные летальные и токсичные дозы, в качестве основы для расчета предельных значений при кратковременном воздействии использовали минимальное значение LD, равное 72 мг/кг для крыс, а не промежуточные значения. Расчет
, мг/кг, проводили по формуле
![]() ,
,
где - минимальная средняя летальная доза, мг/кг;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 250 для экстраполяции данных, полученных на животных в остром опыте, на человеке в случае однократного воздействия. Он учитывает возможность межвидовых различий, изменчивость, присущую человеческой популяции, использование средней, а не действующей, летальной дозы (LD
), качество имеющихся в распоряжении данных и пользу, которую дает применение стерильных медицинских изделий.
Таким образом, предельное значение, полученное в исследованиях на животных, обеспечивает превышение порога безопасности для возможных вредных эффектов, связанных с кратковременным воздействием ЭО на взрослого человека массой 70 кг, по меньшей мере в 250 раз. Другие явления, связанные с острой токсичностью, такие как гемолиз клеток крови, не возникают, даже если максимальная суточная доза 20 мг введена в течение нескольких минут [102], [82]. К тому же, это предельное значение допустимо в случае дозы, не оказывающей действия (NOEL), полученной по результатам изучения подострой токсичности и влияния на репродуктивную функцию, в основе которых лежит минимальная доза NOEL при парентеральном введении, равная 9 мг·кг·сут
или 522 мг/сут, если рассчитывать пропорционально массе женщины 58 кг при многократных введениях.
Д.2.1.3 Особые случаи
Существуют особые обстоятельства, например обширные хирургические операции, когда лечение, спасающее жизнь, значительно изменяет отношение к учету риска. Приведенные здесь предельные значения, зависящие от длительности воздействия, основаны на учете преимуществ и недостатков в менее критических условиях. Вследствие этого существует диапазон, в котором могут изменяться предельные значения в ситуациях, когда идет борьба за жизнь и невозможно соблюдать требования, установленные к предельным значениям.
В процессе разработки настоящего стандарта было признано, что существуют три особых случая, когда предельные значения, приведенные в 4.3, практически не будут обусловлены ограничениями, связанными с самими изделиями, а также существуют данные, полученные при проведении исследований на человеке, которые указывают, что уровни доз, представленные в 4.3, не применимы. Были получены данные на пациентов с интраокулярными линзами, которые следует учесть при пересмотре требований по содержанию остаточных веществ в таких изделиях. Признано, что при обработке крови в оксигенаторах или сепараторах польза перевешивает риск применения таких изделий, и это вызывает необходимость разрешить применять для таких изделий допустимые предельные значения, нормируемые для более коротких видов контактов. В случае использования устройств для экстракорпоральной очистки крови в течение длительного времени может возникнуть потребность в превышении максимальной дозы на протяжении жизни, и это тоже требует рассмотрения.
Д.2.1.3.1 Предельные значения для интраокулярных линз
Предельное значение для остаточных веществ в интраокулярных линзах (изделия, имплантируемые в глаз) составляет 0,5 мкг ЭО на линзу в день. Это предельное значение не соответствует предельным значениям при постоянном воздействии со средней дневной дозой в 0,1 мг (100 мкг) в день в течение всей жизни. Это особый случай, в котором максимальная действующая доза не должна превышать предельного значения в 0,5 мкг/сут на линзу. Такое ограничение необходимо для того, чтобы предотвратить раздражающее действие ЭО на ткани глаза [95], [72], [73], [25].
Д.2.1.3.2 Оксигенаторы и сепараторы крови
Предельное значение воздействующей дозы для таких изделий составляет 60 мг за 24 ч. Данные изделия применяют в ряде операций, таких как хирургические операции на открытом сердце. Это предельное значение учитывает острую потребность пациента во время проведения таких процедур, поскольку в него заложено превышение фактора безопасности в 80 раз. В этих обстоятельствах для такого смягчения требований есть основания.
Д.2.1.3.3 Устройства для экстракорпоральной очистки крови
Максимально допустимая доза ЭО, составляющая 2,5 г на протяжении жизни, может быть превышена при условии, что не превышены как суточная доза для ЭО, равная 20 мг, так и месячная доза 60 мг. Чтобы превысить дозу 2,5 г ЭО на протяжении жизни, пациент, которому проводят очистку крови, должен подвергаться воздействию 2 мг ЭО три раза в неделю, и такое воздействие должно продолжаться в течение 8 лет. Если такое воздействие будет продолжаться в течение 70 лет - а никто не подвергается такому лечению так долго - риск возникновения рака увеличится с одного случая на 10000 до приблизительно одного случая на 1000. Этот дополнительный риск уравновешивается той пользой, которую дает очистка крови для обеспечения жизнедеятельности.
Д.2.2 Определение предельных значений для остаточного содержания ЭХГ
Д.2.2.1 Основной подход
Предельные значения остаточного содержания ЭХГ в медицинских изделиях устанавливали, используя методологию, изложенную в Д.2.1 для ЭО, но не применяя метод количественной статистической оценки риска при постоянном воздействии, который показывает превышение риска возникновения рака один случай на 10000. При проведении биологических исследований на животных ЭХГ не проявил себя как вероятный канцероген. Согласительными группами и законодательными организациями он даже не рассматривается как возможный канцероген для человека. Предельные значения содержания ЭХГ в медицинских изделиях устанавливали на основе анализа многочисленных литературных данных. Данные по острой токсичности, действию на органы-мишени и хронической токсичности, полученные на животных, посчитали наиболее пригодными для расчета предельных значений способом, который изложен в Д.2.2.2.
Д.2.2.2 Общее рассмотрение
Данные по острой токсичности и результаты, полученные при многократном введении доз, показывают, что при кожном, оральном и парентеральном введении ЭХГ легко включается в обменные процессы. Анализ средних летальных доз (LD) и доз, не оказывающих воздействия (NOEL), также приводит к выводу, что воздействие ЭХГ в установленные интервалы времени, кратковременное воздействие и т.д., сравнимы при оральном и парентеральном введении. Согласно данным, полученным при изучении подострой и хронической токсичности, ЭХГ не оказывает более сильного действия при увеличении продолжительности воздействия. Несмотря на то, что не замечено проявление токсичности ЭХГ по отношению к органам-мишеням, установленное действие на органы-мишени может изменяться при изменении способа введения и продолжительности воздействия. Предельные значения допустимых суточных доз, которые представлены в последующих разделах, отражают эти общие наблюдения.
Д.2.2.2.1 Предельное значение при постоянном воздействии
Предельное значение при воздействии от 30 сут и на протяжении всей жизни составляет 2 мг/сут. Оно не должно превышать 12 мг для отдельно взятых суток, или 60 мг в месяц либо 50000 мг на протяжении всей жизни. Эти предельные значения получены на основе данных по хронической токсичности и канцерогенности, которые приведены в работах [44], [69], [79]. В этих исследованиях крысы до возраста двух лет получали ЭХГ в питьевой воде. ЭХГ вводили крысам путем подкожных инъекций по крайней мере в течение года, а также путем накожных аппликаций крысам и мышам в течение 103-104 недель. Дозы варьировались от 0,086 до 71 мг·кг·сут
или более. При этом не наблюдалось увеличения числа случаев возникновения опухолей, связанного с введением ЭХГ, или проявления хронической токсичности, кроме возможного снижения жизнеспособности крыс [44]. Результирующие данные, послужившие основой для расчета прогнозируемых предельных значений при постоянном воздействии, приведены в таблице Д.5.
Таблица Д.5 - Результирующие данные, использованные при определении предельных значений для ЭХГ при постоянном воздействии
Вид исследования | Доза NOEL, орально | Доза NOEL, парентерально | Доза NOEL, накожно |
мг·кг | |||
Хроническая токсичность | 4 LOEL [44] | 2,9 - значение, рассчитанное исходя из введения 10 мг/кг дважды в неделю [69] | Нет данных |
Канцерогенность | 16 | Нет данных | 71 - значение, рассчитанное исходя из введения 100 мг/кг пять раз в неделю |
| |||
Анализ данных, полученных при оральном и парентеральном введении, позволяет прийти к выводу, что дозы ЭХГ, не оказывающие эффекта при постоянном воздействии, т.е. от 30 сут и на протяжении жизни, сравнимы и сходны с теми, которые были получены при изучении подострой токсичности и влияния на репродуктивную функцию. Животные более чувствительны к общетоксическому действию, оказываемому ЭХГ, чем к его способности, если она существует, вызывать рак.
Минимальная доза, не оказывающая действия, при изучении хронической токсичности составляющая 2,9 мг·кг·сут
при подкожном введении крысам в течение по меньшей мере года, а при изучении возникновения опухолей составляющая 16 мг·кг
·сут
при оральном введении крысам в течение 24 мес, положена в основу расчета прогнозируемого предельного значения при постоянном воздействии
, мг/сут, которое рассчитывают по формуле
![]() ,
,
где - минимальная доза, не оказывающая действия при изучении хронической токсичности, мг·кг
·сут
;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 100 (фактор безопасности, равный 10, умноженный на модифицирующий фактор 10), отражающий обычную экстраполяцию данных, полученных на животных, на человека;
![]() , мг/сут, рассчитывают по формуле
, мг/сут, рассчитывают по формуле
![]() ,
,
где - минимальная доза, не оказывающая действия при изучении возникновения опухолей (реально увеличения случаев возникновения опухолей не наблюдалось), мг·кг
·сут
;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 100 (фактор безопасности, равный 100, умноженный на модифицирующий фактор, равный 1), отражающий отсутствие возникновения опухолей при исследованиях на животных.
При изучении этих прогнозируемых предельных значений 2 и 11 мг/сут было установлено, что доза 2 мг/сут будет достаточной для преодоления вредного действия ЭХГ, возникающего при постоянном воздействии. Таким образом, предельное значение, основанное на данных, полученных в исследованиях на животных, обеспечивает как минимум 100-кратный порог безопасности для возможных вредных эффектов, связанных с постоянным воздействием ЭХГ на взрослого человека массой 70 кг.
Д.2.2.2.2 Предельное значение при длительном воздействии
Предельное значение при воздействии от 24 ч до 30 сут составляет 2 мг/сут, и не должно превышать 12 мг для отдельно взятых суток или 60 мг в месяц. В основе этого предельного значения лежат данные по изучению подострой токсичности и влияния на репродуктивную функцию (тератогенность), полученные для животных нескольких видов. Эти данные приводятся многими исследователями [6], [83], [11], [5], [109], [20], [46], [47].
При многократном оральном и парентеральном введении, продолжавшемся различные периоды времени вплоть до 403 сут, ЭХГ оказывал разнообразные вредные эффекты, включая смерть (сопровождающуюся увеличением массы отдельных органов, явлением мускатной печени, геморрагией в ткани надпочечников, геморрагией в ткани гипофиза, кровоизлияниями в желудочно-кишечный тракт, миокардитами, гиперемией щитовидной железы, застойными явлениями в легких, наблюдавшимися в одном исследовании), уменьшение массы тела и замедление роста, увеличение массы мозга, надпочечников, почек, легких и щитовидной железы, небольшое уменьшение и повреждение яичек, рвоту, уменьшение гемоглобина, гематокритного числа и гематокрита, повреждения печени, эктопический гемопоэз, гиперплазию костного мозга, а также сдвиг лейкоцитарной формулы в сторону образования лимфоцитов. Дозы варьировались от 2,7 до 93 мг·кг·сут
и более. Изучение влияния на репродуктивную функцию включало в себя в основном тератологические исследования, в которых ЭХГ вводили на разных стадиях беременности. В этих исследованиях ЭХГ оказывал токсическое действие на материнский организм, проявлял фетотоксическое действие и в одном из исследований приводил к увеличению пороков развития плода. Последний эффект проявлялся только в потомстве мышей, которым вводили ЭХГ внутривенно в дозе 120 мг·кг
·сут
. Данная доза соответствует области острой летальности [47]. Результирующие данные, которые положены в основу расчета предельного значения при длительном воздействии, представлены в таблице Д.6.
Таблица Д.6 - Результирующие данные, использованные для определения предельных значений для ЭХГ при длительном воздействии
Вид исследования | Доза NOEL, орально | Доза NOEL, парентерально |
мг·кг | ||
Подострая токсичность | 13 [83] | 2,7, что соответствует введению 6,4 три раза |
Изучение влияния на репродуктивную функцию | 50 [20] | 9 [45] |
Анализ этих данных позволяет прийти к выводу, что не оказывающие действия дозы ЭХГ для периодов длительного воздействия, то есть от 1 до 30 сут, сравнимы, независимо от того, является ли это действием на специфический орган-мишень или репродуктивную функцию, и не зависят от способа введения. Животные могут оказаться более чувствительными к общему токсическому действию ЭХГ на организм, чем к его способности оказывать вредное влияние на репродуктивную функцию. Минимальную дозу NOEL (не оказывающую действия) 2,7 мг/кг при парентеральном введении, полученную при интраперитонеальном исследовании на крысах, использовали в качестве основы для расчета предельного значения . Расчет
, мг/сут, проводят по формуле
![]() ,
,
где - минимальная доза, не оказывающая действия при изучении подострой токсичности и влияния на репродуктивную функцию при парентеральном введении, мг·кг
·сут
;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 100 (фактор безопасности 100, умноженный на модифицирующий фактор 1).
Поскольку рассчитанное предельное значение немного меньше, чем действительное (1,9 мг/сут против 2 мг/сут), считают, что последнее вполне достаточно обеспечивает порог безопасности, если иметь в виду, что ЭХГ не дает увеличения в токсичности при постоянном воздействии по сравнению с длительным воздействием. Таким образом, предельное значение, основанное на данных, полученных в исследованиях на животных, обеспечивает почти 100-кратный порог безопасности для возможных вредных эффектов, связанных с длительным воздействием ЭХГ на взрослого человека массой 70 кг.
Д.2.2.3 Предельное значение при ограниченном воздействии
Предельное значение при продолжительности воздействия менее 24 ч составляет 12 мг. В основе этого предельного значения лежат данные по острой токсичности, полученные на нескольких видах животных. Эти данные приведены рядом исследователей [90], [109], [57], [58], [59], [93], [69], [108]. Ввиду того, что было рассмотрено и оценено ограниченное количество данных по острой токсичности по сравнению с данными о средней летальной дозе, они не годились для определения предельного значения. Данные по средним летальным дозам приведены в таблице Д.7.
Таблица Д.7 - Результирующие данные, использованные при определении предельных значений для ЭХГ при кратковременном воздействии
В миллиграммах на килограмм
Орально LD | Внутривенно LD | Интраперитонеально LD | Подкожно LD | Другое LD |
Кожа | ||||
Крыса: 50 | Крыса: 67 | Крыса: 44 | Крыса: 60 | |
Крыса: 60 | Кролик: 80 | Крыса: 58 | Крыса: 72 | Кролик: 67,8 |
Кролик: 60 | Крыса: 84 | Крыса: 60 | Кролик: 100 | Морская свинка: 84 |
Крыса: 70 | Крыса: 100 | Крыса: 63 | Мышь: 120 | |
Крыса: 71,3 | Крыса: 110 | Крыса: 64 | Мышь: 150 | |
Крыса: 72 | Мышь: 120 | Крыса: 70 | ||
Мышь: 80 | Кролик: 80 | |||
Мышь: 81,4 | Кролик: 84,6 | |||
Мышь: 91 | Морская свинка: 85 | |||
Мышь: 95 | Морская свинка: 85,5 | |||
Морская свинка: 110 | Кролик: 90 | |||
Мышь: 150 | Мышь: 97 | |||
Мышь: 180 | Мышь: 98,4 | |||
Мышь: 120 | ||||
Мышь: 130 |
Анализ данных, представленных в таблице Д.7, позволяет сделать вывод, что токсичность ЭХГ при кратковременном воздействии, то есть менее 24 ч, почти одинакова и не зависит от способа введения. Так как эти данные отражают среднюю летальную дозу, а не минимальные летальные и токсические дозы, минимальное значение LD, равное 44 мг/кг, полученное для крыс при интраперитонеальном введении, использовали скорее как промежуточное значение, взятое за основу при расчете предельного значения при кратковременном воздействии
. Расчет
, мг/сут, проводят по формуле
![]() ,
,
где - минимальная средняя летальная доза, мг/кг;
- масса тела взрослого человека, 70 кг;
- порог безопасности, равный 250, для экстраполяции полученных на животных данных по острой токсичности, на человека при однократном введении. Это учитывает возможность видовых различий, изменчивость, присущую человеческой популяции, тот факт, что использовали среднюю летальную дозу (LD
), а не данные по дозе, не оказывающей действия, качество имеющихся в распоряжении данных и ту пользу, которую дает использование стерильных изделий.
Таким образом, предельное значение, полученное в исследованиях на животных, обеспечивает превышение порога безопасности для возможных вредных эффектов, связанных с кратковременным воздействием ЭХГ на взрослого человека массой 70 кг по меньшей мере в 250 раз. Кроме того, это предельное значение пригодно и с точки зрения оценки доз, не оказывающих действия (NOEL), полученных из данных по изучению подострой токсичности и влияния на репродуктивную функцию, исходящих из минимальной дозы NOEL, равной 2,7 мг·кг·сут
или 189 мг, по отношению к взрослому человеку массой 70 кг при многократном введении.
Д.2.3 Определение предельных значений остаточного содержания ЭГ
Подробно обсуждается оценка риска, вызванного ЭГ, полученная с помощью методов, аналогичных тем, которые использовались для ЭО и ЭХГ. Данная оценка, основанная на изучении острой токсичности на животных [91], [109], [56], [114], [48], [69], [93] и на человеке [91], показывает, что при кратковременном воздействии допустимы дозы от 435 до 588 мг/сут; согласно данным по изучению подострой токсичности и влияния на репродуктивную функцию, полученным на животных [28], [109], [103], при длительном воздействии допустима доза 30 мг/сут или 900 мг в месяц; согласно данным по хронической токсичности и отсутствию канцерогенного действия, при постоянном воздействии допустимая доза составляет 30 мг/сутки или 750 г в течение жизни. Для остаточного содержания ЭГ не требуется устанавливать максимально допустимые предельные значения. Если остаточное содержание ЭО контролируется на уровне установленных здесь предельных значений, то маловероятно, что биологически значимые количества ЭГ будут присутствовать в изделии [22], [76], [101].
Д.3 Определение остаточного содержания ЭО и ЭХГ [4.4]
Д.3.1 Экстракция из изделий
Критическим параметром в регулировании остаточного содержания ЭО при стерилизации является доза, которую может получить пациент или пользователь при применении изделий, стерилизованных данным способом. Для того чтобы оценить дозу, полученную пациентом или пользователем, необходимо применять экстракционные методы, которые моделируют условия обычного применения изделия. В некоторых случаях этого можно достигнуть путем заполнения изделия водой, в то время как в других случаях может потребоваться более сложное моделирование, включающее постоянный поток жидкости. Установлено, что если в исчерпывающей экстракции при определении остаточных веществ, присутствующих в изделии, соблюдаются все требования, тогда экстракция, моделирующая условия применения, может оказаться ненужной.
Используемое понятие исчерпывающей экстракции включает положение, согласно которому экстракция должна продолжаться до тех пор, пока на последнем этапе полученный выход анализируемого вещества будет составлять менее 10% от выхода анализируемого вещества при первой экстракции. Данное требование не подходит, когда выход при первой экстракции очень мал. Последнее бывает в случае изделий с малым содержанием остаточных веществ или в образцах, из которых анализируемое вещество выделяется с очень малой скоростью. В таких случаях экстракцию следует продолжать до тех пор, пока увеличение общего содержания анализируемого вещества, экстрагируемого за несколько этапов, становится аналитически незначимым.
Д.3.2 Аналитические методы
Д.3.2.1 Стабильность ЭО в этиловом спирте
Во время межлабораторного сравнительного изучения метода определения ЭО, описанного в Б.6.4 [81], было проведено исследование стабильности растворов стандартного образца ЭО в этиловом спирте. Растворы ЭО в концентрациях 25, 50 и 100 мкг/мл были приготовлены и хранились как при температуре холодильной камеры, так и при 40 °С. Эти растворы анализировали в разные периоды времени в течение 6 недель. Данное исследование показало, что за 2 недели при 40 °С концентрация ЭО снижалась до 70% от исходной концентрации для растворов стандартного образца с концентрацией 50 и 100 мкг/мл. В случае хранения при температуре холодильной камеры (плюс 5 °С) вплоть до 60 сут все растворы оставались стабильными в пределах 10% от исходной концентрации.
Д.3.2.2 Стабильность ЭХГ
Перед межлабораторным сравнительным изучением ЭХГ (и ЭГ) 111 лабораторий участвовали в изучении стабильности растворов стандартного образца ЭХГ. Водные растворы ЭХГ были приготовлены в одной лаборатории и переданы всем участникам эксперимента. До прибытия на место анализа растворы хранились при температуре холодильной камеры. Эти растворы анализировали, применяя различные типы колонок, в разные периоды времени: сразу после доставки, спустя неделю и через 2, 3, 4, 8 и 12 недель после доставки. Изучение показало, что в течение первых 2 недель концентрация значительно не изменялась. Было сделано заключение, что растворы стандартного образца ЭХГ стабильны в случае хранения при температуре холодильной камеры в течение по крайней мере 14 сут.
Д.3.2.3 Линейность стандартной кривой
В идеале методики, представленные в настоящем стандарте, должны быть применимы ко всей области концентраций, необходимых для оценки соответствия предельным значениям, установленным в 4.3. Однако во время межлабораторного сравнительного изучения, проведенного с использованием этих методик, линейная область для ЭО при анализе соответствовала концентрациям от 2 до 50 мкг/мл, а линейный диапазон при анализе ЭХГ соответствовал концентрациям от 3 до 15 мкг/мл. На основании личного опыта участников этого международного исследования линейная область этих аналитических систем может быть без ущерба расширена до концентрации 100 мкг/мл для ЭО и ЭХГ. В настоящий момент нет данных для решения вопроса, могут ли области линейности быть расширены в сторону более низких концентраций стандартных растворов.
Д.3.3 Данные анализа и их интерпретация [4.4.7]
В 4.4.7 представлена соответствующая обработка данных, которая дает возможность аналитику вычислить уровни остаточных веществ в изделии и на основании этого возможную дозу, воздействующую на пациента. Это позволяет выпускать продукцию в соответствии с требованиями, перечисленными в 4.3.
ПРИЛОЖЕНИЕ Е (справочное). Определение этиленоксида
ПРИЛОЖЕНИЕ Е
(справочное)
Остаточные количества этиленоксида (ЭО) в вытяжках из изделий определяют методом газовой хроматографии.
Средства контроля, вспомогательные устройства и химические реактивы приведены в таблице E.1.
Таблица E.1 - Средства контроля, вспомогательные устройства и химические реактивы
Оборудование и реактивы | Требования | Нормативные документы |
Оборудование | ||
Газовый хроматограф с | Тип 3700; | |
Пламенно-ионизационным | Хром-5; | |
Детектором и интегратором | "Шимадзу" и др. | |
Баллоны со сжатыми газами: | ||
Гелием | ГОСТ 15860 | |
Водородом* | ГОСТ 3022 | |
Воздухом** | ГОСТ 17433 | |
Шприц стеклянный | Объем - 2,0 мл; цена деления 0,2 мл | |
Шприц микролитровый | Объем - 10 мкл | |
Весы аналитические | Погрешность взвешивания 0,1 мг | |
Стеклянные флаконы с резиновыми прокладками и пластмассовыми крышками с отверстиями посередине | Объем - 60-65 мл | |
Реактивы | ||
Этиленоксид С | ГОСТ 7568 | |
Вода дистиллированная | ГОСТ 6709 | |
Стеклянная колонка 1,6 м | ||
* Допускается использование генератора водорода, обеспечивающего давление водорода 98,1-196,1 кПа. ** Допускается использование воздушного компрессора, обеспечивающего давление 392,3-490,3 кПа. | ||
E.1 Приготовление растворов стандартного образца ЭО
Все работы, связанные с приготовлением и использованием растворов стандартного образца ЭО, проводят с соблюдением условий герметичности. Стеклянный флакон объемом 60-65 мл заполняют взвешенным (с погрешностью до 0,1 мг) количеством дистиллированной воды так, чтобы объем незаполненного пространства составлял примерно 1 мл. Флакон герметизируют с помощью резиновой прокладки и пластмассовой крышки с отверстием посередине. Затем из охлажденной до 0 °С емкости с ЭО охлажденным микрошприцем вводят во флакон примерно 10 мкл (около 9 мг) жидкой ЭО, массу которой определяют взвешиванием (с погрешностью до 0,1 мг). Получают раствор с концентрацией ЭО примерно 150 мг/л, который тщательно перемешивают в течение 15 мин. Растворы стандартного образца с содержанием ЭО от 0,5 до 5 мг/л готовят объемным методом путем разбавления стандартного образца дистиллированной водой, используя набор микрошприцев и флаконов, подготовленных аналогично вышеизложенному.
Е.2 Проведение анализа
1 мкл раствора стандартного образца или вытяжки вводят в испаритель хроматографа. Для каждого раствора стандартного образца или вытяжки проводят не менее пяти параллельных определений. Параметры хроматографического определения приведены в таблице Е.2.
Таблица Е.2 - Параметры хроматографического определения ЭО
Параметры хроматографирования | Значение | |
Температура, °С: | ||
- термостата колонок | 150 | |
- испарителя | 250 | |
- детектора | 250 | |
Скорость газов, мл/мин: | ||
- гелия | 30 | |
- водорода | 30 | |
- воздуха | 300 | |
Абсолютное время удерживания, мин | 1,20 | |
Минимальная определяемая концентрация, мг/л | 0,1 | |
Допускается изменение условий хроматографирования в пределах, обеспечивающих определение ЭО в соответствии с требованиями настоящего стандарта.
Площади пиков определяют с помощью электронного интегратора. Строят калибровочный график в координатах, откладывая по оси абсцисс концентрацию определяемого вещества в растворе стандартного образца, мг/л, по оси ординат - площади соответствующих пиков, мкВ·с.
Е.3 Обработка результатов
Концентрацию ЭО в анализируемой вытяжке , мг/л, рассчитывают по формуле
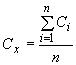 ,
,
где - концентрация определяемого вещества в пробе, найденная по калибровочному графику, мг/л;
- число проб.
С целью оценки полученных результатов рассчитывают среднее арифметическое и среднее квадратическое отклонения, по которым рассчитывают коэффициент вариации в процентах
![]() ,
,
где - среднее квадратическое отклонение;
- среднее арифметическое значение.
В случае получения значения коэффициента вариации более 7% определение повторяют. Если 7%, то результат определения считают статистически достоверным.
ПРИЛОЖЕНИЕ Ж (справочное). Библиография
ПРИЛОЖЕНИЕ Ж
(справочное)
[1] ISO 11135: 1994, Medical devices - Validation and routine control of ethylene oxide sterilization
[2] EN 550: 1994, Sterilization of medical devices - Validation and routine control of ethylene oxide sterilization
[3] AAMI EO-VRSU 3/81; superseded by AAMI GVR - 1987, Good hospital practice: Ethylene oxide gas - Ventilation recommendations and safe use. Arlington, VA: AAMI, 1981
[4] Adler, N. Residual ethylene oxide and ethelene glycol in ethylene oxide sterilized pharmaceuticals. J. Pharm. Sci. 54(50) 1965; pp.735-742
[5] Alleva F. (Cited in Balazs, 1976)
[6] Ambrose, A. Toxicological studies of compounds investigated for use as inhibitors of biological processes. II Toxicity of ethylene chlorohydrin. Arch. Ind. Hyg. Occup. Med. 2 1950; pp.582-597
[7] Andersen, S. Ethylene oxide toxicity. J. Lab. Clin. Med. 77(2) 1971; pp.346-356
[8] ANSI/AAMI ST29 - 1988, Recommended practice for determining residual ethylene oxide in medical devices. Arlington, VA: AAMI, 1988
[9] ANSI/AAMI ST30 - 1989, Determining residual ethylene chlorohydrin and ethylene glycol in medical devices. Arlington, VA: AAMI 1989
[10] ASTM E691:1979, Standard practice for conducting an interlaboratory comparison study to determine the precision of test methods. Philadelphia, PA: ASTM, 1979
[11] Balazs, Т. Toxicity of ethylene oxide and chloroethanol. FDA BY-lines No. 3 1976; pp.150-155
[12] Ball, N.A Determination of ethylene chlorohydrin and ethylene glycol in aqueous solutions and ethylene oxide in associated plastics. J. Pharm. Sci. 73(9) 1984; pp.1305-1307
[13] Blood, F. Chronic toxicity of ethylene glycol in rat. Fd. Cosmet. Tox. 3 1965; pp.229-234
[14] Brobst, K.M and Han, Т. Determination of chlorohydrins in hydroxypropyl starch ethers. J. Assoc. Off. Anal. Chem. 54(5) 1971; pp.1093-1094
[15] Brown, D.J. Determination of ethylene oxide and ethylene chlorohydrin in plastic and rubber surgical equipment sterilized with ethylene oxide. J. Assoc. Off. Anal. Chem. 53(20) 1970; pp.263-267
[16] Bruch, C.W. Industrial Sterilization. Phillips, G.B, Miller, W.S. (Eds.) Durham, NC: Duke University Press 1973; pp.49-77
[17] Carpenter, С., Smyth, H. and Pozzani, U. The assay of acute vapor toxicity, and the grading and interpretation of results on 96 chemical compounds. J. Ind. Hyg. Toxicol. 31 1949; pp.343-349 (Cited in EPA, 19850)
[18] Chesler, S.N., Rebbert, R.E. and Enagonio, D.P. Evaluation of AAMI EO residues recomended practice and a determination of EO kinetics in water. Washington, DC; National Bureau of Standards, Department of Commerce, Oct. 1985
[19] Conine, D., Naumann, B. and Hecker, L. Setting health-based residue limits for contaminants in pharmaceuticals and medical devices. Quality Assurance: Good Practice, Regulation, and Law. 1 1992; pp.171-180
[20] Courtney, R., Andrews, J. and Grady, M. Teratogenic evaluation of ethylene chlorohydrin (Ech, 2-chloroethanol) in mice. J. Environ. Sci. Health. B17 (40) 1982; pp.381-391
[21] Cyr, W.H., Glaser, Z.R. and Jacobs, M.E. CDRH risk assessment of EO residues on sterilized medical devices. In: Jorkasky, J. (Ed.) Sterilization in the 1990s (Health Industry Manufacturers' Association Report No. HIMA 89-1). Washington, DC: HIMA, 1989; pp.269-285
[22] Danielson J.W., Snell, R.P. and Oxborrow, G.S. Detection and quantification of ethylene oxide, 2-chloroethanol, and ethylene glycol with capillary gas chromatography. J. Chromatogr. 28 1990; pp.97-101
[23] Depass, L., Garman, R., Woodside, M., Giddens, W., Maronpot, R. and Wiel, C. Chronic toxicity and carcinogenicity tudies of ethylene glycol in rats and mice. Fund. Appl. Tox. 7 1986; pp.547-565
[24] Dunkelberg. H. Carcinogenicity of ethylene oxide and 1,2-propylene oxide upon intragastric administration to rats. Br. J. Cancer. 46 1982; pp.924-933
[25] Edelhauser, H., Antoine, M., Pederson, H., Hiddeman, J. and Harris, R. Intraocular safety evaluation of ethylene oxide and sterilant residues. J. Toxicol. Cut. and Ocular Toxicol. 2 1983; pp.7-39
[26] Environ. Ethylene Oxide Residues on Sterilized Medical Devices. Washington, DC. Environ Corporation, 1987. (Also in: Health Industry Manufacturers' Association, HIMA Report 88-6. Washington, DC: HIMA, 1988)
[27] Ettre, L.S. and Jones, E. Quantitative analysis with Headspace gas chromatography using multiple headspace extraction. Chromatography Newsletter. 12(1) July 1984
[28] Gaunt, J., Hardy, J., Gangolli, S., Butterworth, K. and Lloyd, A. BIBRA. 14 1975; p.109. (Cited in Rowe and Wolf, 1982 and Environ, 1987)
[29] Glaser, Z.R. Ethylene oxide: Toxicology review and field study results of hospital use. J. Environ. Path. Tox. 2 1979; pp.173-208
[30] Golberg, L. Hazard Assessment of Ethylene Oxide. Boca Raton, FL.: CRC Press, 1986
[31] Guess, W. Tissue reactions to 2-chloroethanol in rabbits. Tox. Appl. Pharm. 16 1970; pp.382-390
[32] Guidelines for data acquisition and data quality evaluation in environmental chemistry. Anal. Chem. 52(140) 1980
[33] Hackett, P., Brown, R., Buschboom, R., Clark, M., Miller, R., Music, R., Rowe, S., Schirmer, R. and Sikov, М. Teratogenic Study of Ethylene Oxide and Propylene Oxide and n-Butyl Acetate (NIOSH Contract No. 210-80-0013). Richland, WA: Battelle Pacific Northwest Laboratories, 1982. (Cited in EPA, 1985)
[34] Handlos, V. Determination of gas residuals in ethylene oxide sterilized materials - A literature survey. Archiv. Pharm. Chemi. Sci. 4 1976; pp.73-80
[35] Handlos, V. The hazards of ethylene oxide sterilization. Arch. Pharm. Chemi. Sci. 7 1979; pp.939-949
[36] Hartman, P.A. and Bowman, P.B. Simple GLC determination of ethylene oxide and its reaction products in drug and formulations. J. Pharm. Sci. 66(6) 1977; pp.789-792
[37] Health Industry Manufacturers' Assiciation. Guidelines for the Analysis of Ethylene Oxide Residues in Medical Devices (HIMA Document No. 1, Vol. 20. Washington, DC: HIMA, 1980
[38] Hollingworth, R., Rowe, V., Oyen, F., McCallister, D. and Spencer, H. Toxicity of ethylene oxide determined on experimental animals. AMA Arch. Ind. Health. 13 1956; pp.217-227
[39] Hubaux, A. and Gilbert, V. Decision and detection limits for linear calibration curves. Anal. Chem. 42(8) 1970; pp.849-855
[40] Improved detection and separation of glycols and ethylene oxide residues using GC. (Bulletin 789), Supelco, Inc.; 1980
[41] Jacobson, K., Hackley, E. and Feinsilver, L. The toxicity of inhaled ethylene oxide and propylene oxide vapors. AMA Arch. Ind. Health. 13 1956; pp.237-244
[42] Japan Association of Disposable Medical Device Industries. Guideline for ethylene oxide sterilization of disposable medical devices (second edition). Dec. 1989
[43] Johnson, М. Metabolism of chloroethanol in the rat. Bioche. Pharmacol. 16 1967a; pp.185-199
[44] Jonson, М. Detoxication of ethylene chlorohydrin. Fd. Cosmet. Tox. 5 1967 b; p.499
[45] Jones-Price, С., Kimmel, Т., Markes, Т., Ledoux, Т., Reel, J., Fisher, P., Langhoff-Paschke, L. and Marr, М. Teratologic Evaluation of Ethylene Oxide (CAS No. 75-78-8) in New Zealand White Rabbits (Final report RB80-EO, NIEHS Contract No. 1-ES-2127). Research Triangle Park, NC: National Institute of Environmental Health Sciences, 1982. (Cited in EPA, 1985)
[46] Jones-Price, С., Marks, Т., Ledoux, Т., Reel, J., Fischer, P., Langhoff-Paschke, L., Marr, М. and Kimmel, C. Teratologic Evaluation of Ethylene Chlorohydrin (CAS No. 107-07-3) in New Zealand White Rabbits (PB85-170959). Research Triangle Park, NC: National Institute of Environmental Health Sciences, 1985a
[47] Jones-Price, C., Mrks, Т., Ledoux, Т., Reel, J., Fisher, P., Langhoff-Paschke, L., Marr, М. and Kimmel, C. Teratologic Evaluation of ethylene Chlorohydrin (CAS No. 107-07-3) in CD-1 mice (PB85-172104). Research Triangle Park, NC: National Institute of Environmental Health Sciences, 1985b
[48] Karel, L., Landing, B. and Harvey, T. The intraperitoneal toxicity of some glycols, glycol ethers and phthalates in mice. Fed. Proceedings. 6 1947; p.342
[49] Kashtock, М. Use of specific retention volumes in evaluation of various types of columns for use in the trace determination of ethylene glycol by gas chronatography. J. Chromatogr. 176 1979; pp.25-35
[50] Kaye, M.M. and Nevell, T.G. Statistical evaluation of methods using headspace gas chromatography for the determination of ethylene oxide. Analyst. 110 1985; pp.1067-1071
[51] Kikuchi, H., Nakamura, A. and Tsuji, K. Gas chromatographic determination with electron capture detection of residual ethylene oxide in intraocular lenses. J. Assoc. Off. Anal. Chem. 71 1988; pp.1057-1062
[52] Kroes, R., Bock, B. and Martis, L. Ethylene oxide extraction and stability in water and blood. Personal communication to the AAMI Committee, Jan. 1985
[53] Kulkarni, R.K., Bartak, D., Ousterhout, D.K. and Leonard, F. Determination of Residual ethylene oxide in catheters by gas-liquid chromatography. J. Biomed. Mat. Res. 2 1968; pp.165-171
[54] Laborde, J. and Kimmel, C. The teratogenicity of ethylene oxide administered intravenously to mice. Tox. Appl. Pharm. 56 1980; pp.16-22
[55] Landen, W.O., Thompson, D.W. and Floyd, K.M Determination of ethylene oxide and ethylene glycol in wet surgical dressings. FDA By-Lines, No.2, 1971
[56] Latven, A. and Molitor, H. Comparison of the toxic, hypnotic and irritating properties of eight organic solvents. J. Pharm. Exp. Ther. 65 1939; pp.89-94
[57] Lawrence, W., Turner, J. and Autian, J. Toxicity of ethylene chlorohydrin I: Acute toxicity studies. J. Pharm. Sci. 60(4) 1971a; pp.568-571
[58] Lawrence, W., m Itoh, R., Turner, J. and Autian, J. Toxicity of ethylene chlorohydrin II: Subchronic toxicity and special tests. J. Pharm. Sci. 60(8) 1971b; pp.1163-1168
[59] Lawrence, W., Dilligham, E., Turner, J. and Autian, J. Toxicity profile of chloroacetaldehyde. J. Pharm. Sci. 61(1) 1972; pp.19-25
[60] Lee, H.T., Daniel, A. and Walker, C. Conformance test procedures (CTP) for verifying the labelling claims for precision, bias, and interferences in in-vitro diagnostic devices used for the quantitative measurement of analytes in human body fluids. In: Bureau of Medical Devices Biometrics Report 8202. Silver Spring, MD: Food and Drug Administration, Apr. 1982
[61] Long, G.L. and Winefordner, J.D. Limit of detection - A closer look at the IUPAC definition. Anal. Chem. 55(7) 1983; pp.712A-724A
[62] Lynch, D., Lewis, Т., Moorma, W., Sabharwal, P. and Burg, J. Toxic and mutagenic effects of ethylene oxide and propylene oxid on spermatogenic functions in Cynomolgus monkeys. Toxicologist. 3:60
[63] Lynch, D., Lewis, Т., Moorman, W., Burg, J., Groth, D., Khan, A., Ackerman, L. and Cockerell, B. Carcinogenic and toxicologic effects of inhaled ethylene oxide and propylene oxide in F344 rats. Tox. Appl. Pharm. 76 1984; pp.69-84
[64] Malanoski, A.J. Analyst perfbmance standards: Determination for and from collaborative studies. J. Assoc. Off. Anal. Chem. 65(6) 1982; pp.1333-1338
[65] Manius, G.J. Determination of ethylene oxide, ethylene chlorohydrin and ethylene glycol residues in ophthalmic solution at proposed concentration limits. J. Pharm. Sci. 68(12) 1979; pp.1547-1549
[66] Marlowe, D.E., Lao, N.T., Lao C.S., Eaton A.R. and Page, B.F.J. Interlaboratory Comparison of Ethylene Oxide Residue Analysis Test Methods (HHS Publication FDA 86-4204). Mar. 1986
[67] Marlowe, D.E. Summery of results from interlaboratory comparison of ethylene oxide residue analysis test methods. Paper presented at AAMI Conference on Inhospital EO Sterilization, Arlington, Virginia, Nov. 1983
[68] Marlowe, D.E., Lao, N.T., Eaton, A.R., Page, B.F.J. and Lao, C.S. An interlaboratory comparison of analytical methods for ethylene oxide. J. Pharm. Sci. 76 1986; pp.333-337
[69] Mason, M., Cate, С. and Baker, J. Toxicology and carcinogenesis of various chemicals used in the preparation of vaccines. Clin. Toxicol. 4(2) 1971; pp.185-204
[70] Matsumoto, Т., Hardaway, R.M., Pani, K.C., Sater, C.M., Bartak, D.E. and Margetis, P.M. Safe standard of aeration for ethylene oxide sterilized supplies. Arch. Surg. 96 1968; pp.464-470
[71] McDonald, Т., Roberts, M., and Borgmarnn, A. Ocular toxicity of ethylene chlorohydrin and ethylene glycol in rabbit eyes. Tox. Appl. Pharm. 21 1972; pp.143-150
[72] McDonald, Т., Kasten, K., Hervey; R., Gregg, S., Borgmann, A. and Murcheson, T. Acute ocular toxicity of ethylene oxide, ethylene glycol and ethylene chlorohydrin. Bull. Parent. Drug Assoc. 27(4) 1973; pp.153-164
[73] McDonald, Т., Kasten, K., Hervey, R., Gregg, S. and Button, B. Acute ocular toxicity for normal and irritated rabbit eyes and subacute ocular toxicity for ethylene oxide, ethylene chlorohydrin and ethylene glycol. Bull. Parent. Drug Assoc. 31(1) 1977; pp.25-32
[74] Mogenhan, J.A., Whitebourne, J.E. and Ernst, R.R. Determination of ethylene oxide in surgical materials by vacuum extraction and gas chromatography. J. Pharm. Sci. 60(2) 1971; pp.222-224
[75] Morris, Т., Nelson, M. and Calvery, A. Observations on the chronic toxicities of propylene glycol, ethylene glycol, dietrhylene glycol, ethylene glycol mono-ethyl-ether, and diethylene glycol mono-methyl-ether. J. Pharm. Exp. Ther. 74 1942; pp.266-273
[76] Muzeni, R.J. Rapid gas chromatographic determination of ethylene oxide, ethylene chlorohydrin, and ethylene glycol residues in rubber catheters. J. Assoc. Off. Anal. Chem. 68(3) 1985; pp.506-508
[77] Nakamura, A., Kikuchi, H. and Tsuji, K. Determination of ethylene oxide residue in commercially available intraocular lenses by new sensitive method (Electron capture detection/gas chromatography). IOL.3 1989; pp.4-8
[78] Northup, S., Weinckowski, D., Martis, L. and Darby, T. Toxicity caused by acute and subacute intravenous administration of ethylene oxide in the rat. J. Environ. Pathol. Toxicol. 5 1981; pp.617-623
[79] National Toxicology Program. Toxicology and Carcinogenicity Studies of 2-Chloroethanol (Ethylene Chlorohydrin) (CAS. No. 107-07-03) in F344/N Rats and Swiss CD-1 Mice (Dermal Studies) (NTR TR275, NIH Publication 86-2531). Research Triangle Park, NC; NTR, 1985
[80] National Toxicology Program. Toxicology and Carcinogenicity Studies of ethylene Oxide (CAS No. 75-21-8) in B6C3F1 Mice (Inhalation Studies) (NTR Technical Report 326, U.S. Department of Health and Human Servies, Public Health Services, National Institute of Health). Research Triangle Park, NC: NTR, 1987
[81] Oba, Т., Tsuji, K., Mizymachi, S., Kikuchi, H., Shintani, H., lida, K. and Meguro, K. Studies on residual ethylene oxide in medical devices (1) - Gas chromatographic determination of ethylene oxide in plastics. Ikakikai-gaku. 52(30) 1982; pp.134-139
[82] Ohba, T. Safety of residual ethylene oxide and ethylene oxide concentrations in the working environment of sterilization facilities. In: Gaughren, E., Morrissey R.; Yousen, W., (Eds.). Sterilization of Medical Products Volume IV. Montreal, Canada; Plyscience Publications, Inc., 1986; pp.172-177
[83] Oser, В., Morgareidge, K., Cox, G. and Carson, J. Short-term toxicity of ethylene chlorohydrin (ECH) in rats, dogs and monkeys. Fd. Cosmet. Tox. 13 1975; pp.313-315
[84] Patel, A. (unpublished das presented to ISO/TC 194/WG 11 by A. Patel, Alcon Laboratories, Inc. and his colleagues at the WG meeting in Menneapolis, MN, Sept. 1993)
[85] Pharmaceutical Manufacturers' Association. Procedures for setting limits for volatile organic solvents with methylene chliride as an example of the process. Committee on Rational Specifications for Impurities in Bulk Drug Substances - Pharmaceutical Manufacturers' Association. In: Pharmacopeial Forum. Washington, DC: PMA, Nov.-Dec. 1989; pp.5748-5759
[86] Pharmaceutical Manufacturers' Association. Application of the PMA procedure for setting residue limits for organic volatile solvents in pharmaceuticals to etylene oxide. Prepared by D.L. Conine and the PMA subcommittee of Industrial Toxicologists. Procedures for setting limits for organic volatile solvents with chloroform 1,4-dioxane, ethylene oxide, and trichloroethylene as examples of the process. Committee on Rational Specifications for Impurities in Bulk Drug Substances - Pharmaceutical Manufacturers' Association. In: Pharmacopeial Forum. Washington, DC: PMA, May-June 1990; pp.557-572
[87] Ragelis, E.P., Fisher, B.S., Kimeck, B.A. and Johnson, C. Isolation and determination of chlorohydrins in foods fumigated with ethylene oxide or propylene oxide. J. Assoc. Off. Anal. Chem. 51(3) 1986; pp.709-717
[88] Romano, S.J. and Renner, J.A. Comparison of analytical methods for residual ethylene oxide analysis. J. Pharm. Sci. 64(8) 1975; pp.1412-1417
[89] Romano, S.J., Renner, J.A. and Letner, P.M. Gas chromatography determination of residual ethylene oxide by head space analysis. Anal. Chem. 45(14) 1973; pp.2327-2230
[90] Rowe, V. and Mccollister, S. Alcohols. Chapter Fifty-Five. In: Clayton, G; Clayton, F. (Eds.). Patty's Industrial Hygiene and Noxicology (3 ed. Vol. 2C Toxicology). New York, NY: John Wiley&Sons, Inc. 1982; pp.4675-4684
[91] Rowe, V. and McCollister, S. Alcohols. Chapter Fifty-five. In: Clayton, G.; (Eds.). Patty's Industrial Hygiene and Toxilogy (3 ed. Vol. 2C Toxicology). New York, NY: John Wiley&Sons, Inc. 1982; pp.4675-4684
[92] PTECS. Registry of Toxic Effects of Chemical Substances 1985-1986. National Institute for Occupational Safety and Health. DHHS (NIOSH) Publication No. 87-114. Rockville, MD. 1987; pp.2361-2362
[93] RTECS. Registry of Toxic Effects of Chemical Substances. National Institute of Occupational Safety and Health. On line. Rockville, MD. 1990
[94] Scudamore, K.A. and Heuser, S.G. Ethylene oxide and its persistent reaction products in waheat flour and other commodities, residues from fumigation or sterilization, and effects of processing. Pesticede Science. 2 1971; pp.80-81
[95] Shimadzu, H., Ohara, K. and Sawa, M. Sterile anterior segment inflammation presumably due to absorbed ethylene oxide to the implanted intraocular lens. Rinsho Ganka (Japanese J. Clin. Ophtalmol.) 40(11) 1986; pp.1219-1225
[96] Snellings, W., Maronpot, R., Zelenak, J. and Laffon, Teratology study in Fischer 344 rats exposed to ethylene oxide by inhalation. Tox. Appl. Pharm. 64 1982a; pp.476-481
[97] Snellings, W., Zelenak, J. and Weil, C. Effects on reproduction in Fischer rats exposed to ethylene oxide by inhalation for one generation. Tox. Appl. Pharm. 63 1982b; pp.382-388
[98] Snelings, W., Well, C. and Maropot, R. A subchronic inhalation study on the toxicologic potential of ethylene oxide in B6C3F1 mice. Tox. Appl. Pharm. 76 1984a; pp.510-518
[99] Snellings, W., Weil, C. and Maronpot, R. A two-year inhalation study of the carcinogenic potential of ethylene oxide in Fischer 344 rats. Tox. Appl. Pharm. 75 1984b; pp.105-117
[100] Snyder, L.R. A rapid approach to selecting the best experimental conditions for high-speed liquid column chromatography - Part 1 Estimating initial sample resolution and the final resolution required by a given problem. J. Chromatogr. Sci. 10 1972; pp.201-212
[101] Spatz, H.D. and Weinberger, J. Determination of ethylene oxide, ethylene chlorohydrin and ethylene glycol by gas chromatography. J. Pharm. Sci. 60(20) 1971; pp.271-274
[102] Tanaka, S., Nakaura, S., Kawashima, K., Kasuya Y. and Omori, Y. Studies on the hemolytic activity and dermal irritability of ethylene oxid and its reaction products. Jap. J. Med. lnstrum. 52(1) 1982; pp.21-28
[103] Tyl, R. Developmental Toxicity Evaluation of Ethylene Glycol Adminisiration by Gavage to DC®-1 Mice: Determination of a No-Observable-Effect Level" (NOEL). Report 51-591. Bushy Run Research Center. Union Carbide Corporation, Export, PA. (Study sposored by Ethylene Glycol Panel.) Washington, DC: Chemical Manufacturers' Association, 1988
[104] U.S. Environmental Protection Agency. Health Assessment Document for Ethylene Oxide (EPA 600//8-84-009F). Research Triangle Park, Inc: EPA, 1985
[105] U.S. Food and Drug Administration. EO, ECH& EG, Proposed maximum residue limits and maximum levels of exposure (HEW/FDA). Federal Register. Washington, DC. 43(122) 1978
[106] U.S. Pharmacopeia. Chromatography (Section 621). United States Pharmacopeial Convention In: United States Pharmacopea (22 ed). Easton, PA: Mack Publishing Co., 1989
[107] Warren, В. The determination of residual ethylene oxide and halogenated hydrocarbon propellants in sterilized plastics. J. Pharm. Pharmacol. 23 (suppl.) 1971; pp.170S-175S
[108] Weil, C. Statistics vs. safety factors and scientific judgement in the evaluation of safety for man. Tox. Appl. Pharm. 21 1972; pp.454-463
[109] Wodaed, G. and Woodard, M. Toxicity of residuals from ethylene oxide gas sterilization. Proceedings of the Health Industry Association Technical Symposium. Washington, D.C.; 1971; pp.140-161
[110] Weinberger, J. GLC Determination of ethylene chlorohydrin following co-sweep extraction. J. Pharm. Sci. 60(4) 1971; pp.545-547
[111] Wesley, F., Rouke, B. and Darbishire, O. The formation of persistent toxic chlorohydrins in foodstuffs by fumigating with ethylene oxide and propylene oxide. J. Food. Sci. 30 1965; pp.1037-1042
[112] Whitbourne, J.E., Mogenhan, J.A. and Ernst, R.R. Determination of 2-chloroethanol in surgical materials by extraction and gas chromatography J. Pharm. Sci. 58(3) 10969; pp.1024-1025
[113] White, J.D. and Bradley, T.J. Residual ethylene oxide in methyl methacrylate polymer powders by GLC. J. Pharm. Sci. 62(10) 1973; pp.1623-1637
[114] Yin, L, Liu, C., Shih l. and Po, K. A study of the teratogenic action of ethylene glycol in rats. Zhonghua Yugangyixue Zazhi. 20(5) 1986; pp.289-290
[115] Zagar, L.A. Determination of residual ethylene oxide in methyl mathacrylate polymer powders by GLC. J. Pharm. Sci. 61(11) 1972; pp.1801-1808
[116] ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
[117] ОСТ 42-513-99 Устройства комплектные эксфузионные, инфузионные и трансфузионные однократного применения. Требования химической и биологической безопасности. Методы испытаний в условиях предприятий-изготовителей