ГОСТ Р ИСО 10993.10-99
Группа Р20
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 10
Исследование раздражающего и сенсибилизирующего действия
Medical devices. Biological evaluation of medical devices.
Part 10. Tests for irritation and sensitization
ОКС 01.140.20*
ОКСТУ 9403
_______________
* В указателе "Национальные стандарты" 2007 год ОКС 11.020. -
Примечание изготовителя базы данных.
Дата введения 2002-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 862-ст
3 Настоящий стандарт, за исключением раздела 3 и приложения Е, представляет собой аутентичный текст международного стандарта ИСО 10993.10-95 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 "Оценка биологического действия медицинских изделий" позволяет обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В стандарты серии ГОСТ Р ИСО 10993, имеющие групповой заголовок "Изделия медицинские. Оценка биологического действия медицинских изделий", входят:
- часть 1 - оценка и исследования;
- часть 3 - исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 - исследование изделий, взаимодействующих с кровью;
- часть 5 - исследование на цитотоксичность: методы in vitro;
- часть 6 - исследование местного действия после имплантации;
- часть 7 - остаточное содержание этиленоксида после стерилизации;
- часть 9 - основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 - исследование раздражающего и сенсибилизирующего действия;
- часть 11 - исследование общетоксического действия;
- часть 12 - приготовление проб и стандартные образцы;
- часть 13 - идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 - моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
Настоящий стандарт оценивает опасность, возникающую при контакте с изделиями, выделяющими химические вещества, которые могут вызывать раздражение кожи и слизистой, раздражение глаз и сенсибилизацию организма.
Методы исследования, изложенные в стандарте, взяты из международных национальных стандартов, директив и нормативов.
Одна из методик исследования сенсибилизирующего действия, применяемая в России, изложена в приложении Е.
Допускается применять другие методы, обеспечивающие оценку биологического действия медицинских изделий в соответствии с требованиями международных стандартов.
1 Область применения
Настоящий стандарт устанавливает методы оценки возможного раздражающего и сенсибилизирующего действия медицинских изделий и материалов.
Настоящий стандарт распространяется на категории изделий в соответствии с ГОСТ Р ИСО 10993.1. Подготовку образцов к исследованиям проводят в соответствии с приложением А.
Примечание - Методы исследования изделий специфического способа применения (оральный, вагинальный, ректальный, на пенис) приведены в приложении Г.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Оценка и исследования.
ГОСТ Р ИСО 10993.12-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Приготовление проб и стандартные образцы.
3 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующие определения:
3.1 аллергенное действие, сенсибилизация и гиперчувствительность замедленного типа: Аллергическая реакция с вовлечением иммунной системы, которая активизируется в результате предварительной кожной сенсибилизации.
3.2 раздражение: Локализованная воспалительная реакция на однократное, повторное или продолжительное воздействие исследуемого вещества без вовлечения иммунного механизма.
3.3 отек: Увеличение объема ткани вследствие патологической инфильтрации жидкости.
3.4 эритема: Покраснение кожи и слизистых оболочек.
3.5 струп: Корка или бесцветное чешуйчатое образование кожи.
3.6 коррозия: Необратимое разъедание кожи в месте контакта с испытуемым веществом.
3.7 изъязвление: Открытая язва вследствие потери поверхностных тканей.
3.8 некроз: Гибель клеток и (или) тканей.
3.9 отрицательный контроль: Материал, который при исследовании в соответствии с ГОСТ Р ИСО 10993.10, не оказывает раздражающего или сенсибилизирующего действия.
3.10 положительный контроль: Материал, который при исследовании в соответствии с ГОСТ Р ИСО 10993.10, оказывает воспроизводимое раздражающее или сенсибилизирующее действие.
3.11 растворитель: Вещество (химикат, наполнитель, среда), используемое для смачивания, разбавления, суспензирования, экстрагирования или растворения испытуемого материала.
3.12 контрольный раствор: Растворитель (3.11), используемый для смачивания, разбавления, суспензирования, экстрагирования или растворения испытуемого материала, который оценивается одновременно со смоченным, разбавленным, суспензированным, экстрагированным или растворенным испытуемым материалом.
3.13 образец: Изделие или его часть, подвергаемые исследованию.
3.14 исследуемая проба: Изделие или вытяжка из него, используемые для изучения раздражающего и (или) сенсибилизирующего действия.
4 Общие положения
В настоящем стандарте обоснована целесообразность поэтапного подхода к исследованиям, включающего в себя частично или полностью следующие этапы:
а) обзор литературы;
б) исследования in vitro (если они доступны и надежны);
в) исследования in vivo;
г) неинвазивные методы испытания на добровольцах.
Обзор литературы включает в себя получение информации о физических и химических свойствах веществ и материалов, а также о сходных по структуре соединениях. Если рН и рКа исследуемой пробы (раствора, жидкости или вытяжки из материала) неизвестны, следует измерить эти показатели до начала исследований in vitro и in vivo.
Исследования in vitro более предпочтительны по сравнению с исследованиями на живом организме и должны постепенно вытеснять последние, поскольку методы in vitro становятся более доступными и надежными.
Для оценки материалов, которые не являются сильными раздражителями и не проявили выраженного сенсибилизирующего действия на этапах а) или б), проводят острые опыты in vivo. Материалы, не проявившие токсического действия в острых опытах, далее подвергают исследованиям при многократном воздействии на организм.
В настоящее время не существует надежных методов in vitro (кроме простейших скрининговых тестов), позволяющих выявить материалы, обладающие раздражающим и сенсибилизирующим действием; существует лишь руководство по проведению исследований in vivo на животных.
Положительный контроль следует применять периодически для подтверждения надежности используемых методов исследований и демонстрации положительной реакции.
Если невозможно адекватно оценить материал с помощью перечисленных методов, необходимо проводить исследования неинвазивными методами на человеческом организме.
5 Методы исследования раздражающего действия
5.1 Факторы, влияющие на проведение исследований и выбор методов
На результаты изучения раздражающего действия оказывают влияние следующие факторы:
- оценка пятна;
- степень поражения (окклюзии);
- способ аппликации исследуемого вещества;
- место аппликации;
- продолжительность экспозиции;
- методика оценки результатов исследований.
Дополнительная информация приведена в приложении Д.
Определенная свобода исследователей в выборе методов и желание модифицировать последние с целью повышения их чувствительности в соответствии с условиями применения материалов, частотой и длительностью их использования требуют сравнения результатов исследований, полученных разными организациями.
Описанные методики используют для исследования материалов и изделий, имеющих многократный и (или) длительный контакт с организмом. После консультаций с производителем исследователь должен спланировать эксперимент таким образом, чтобы его продолжительность и (или) концентрация исследуемого вещества превышали применяемые в медицинской практике. Увеличение концентрации вытяжки из материала учитывают при анализе результатов эксперимента.
При использовании материалов, контактирующих со здоровой и тем более поврежденной кожей, не оправдан даже незначительный риск, однако многие потенциальные раздражители находят широкое применение в связи с преобладанием их полезных свойств.
Следует отметить, что если рН исследуемого образца меньше или равно 2,0 или больше или равно 11,5, материал признают потенциальным раздражителем и дальнейшие исследования его не проводят. Экспериментально доказано, что на возникновение серьезных повреждений влияют также концентрация исследуемого вещества, время контакта и его химические и физические свойства. Если при проведении исследований доза материала сознательно аггравирована, незначительное неблагоприятное воздействие последнего не всегда является основанием для его запрещения.
5.2 Раздражающее действие на кожу
5.2.1 Цель исследования
Оценка способности материала оказывать раздражающее действие на кожу.
5.2.2 Исследуемый материал
Твердые вещества (включая порошки) или жидкость готовят к исследованиям в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б.
5.2.3 Экспериментальные животные и их содержание
Используют половозрелых молодых кроликов-альбиносов одной линии обоего пола весом не менее 2 кг.
Акклиматизацию и уход за животными осуществляют в соответствии с приложением В.
Для первичной оценки исследуемого материала используют одно животное.
При выраженной реакции, полученной при исследовании на одном животном, дальнейшие исследования не проводят.
Если при исследованиях твердых или жидких материалов не наблюдается выраженной реакции, далее используют не менее двух животных, а при исследовании вытяжек из материалов - не менее двух животных на каждую вытяжку.
Если результаты исследований, полученные не менее чем на трех животных, сомнительны или неясны, проводят дополнительные исследования.
5.2.4 Проведения исследований
5.2.4.1 Подготовка животных
За сутки до проведения исследований выстригают шерсть на участках площадью примерно 10x15 см по обеим сторонам спины для аппликации и наблюдения.
Используют животных только со здоровой кожей.
Примечание - Сбривать шерсть на подготовленных участках необязательно, так как практика показала, что это не влияет на результаты исследований.
При многократном воздействии исследования проводят в соответствии с 5.2.4.2, 5.2.4.3 или 5.2.4.4 не более 21 сут.
5.2.4.2 Порошкообразные и жидкие образцы
Наносят 0,5 г или 0,5 мл исследуемого материала на кожу с каждой стороны, как показано на рисунке 1.
Рисунок 1 - Расположение аппликаций на коже кролика
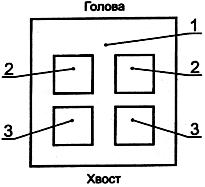
1 - выстриженный участок спины; 2 - исследуемый участок; 3 - контрольный участок (при необходимости)
Рисунок 1 - Расположение аппликаций на коже кролика
Порошкообразный исследуемый материал перед нанесением слегка смачивают водой или другим подходящим растворителем.
Участки с нанесенным материалом сверху покрывают кусочками ткани или марли, сложенными вчетверо, площадью 25x25 мм и фиксируют полупрозрачной повязкой. Время экспозиции не менее 4 ч. Удаляют защитную повязку и кусочки ткани, отмечают положение участков. Затем удаляют остатки исследуемого вещества соответствующими средствами, например теплой водой или другим растворителем, не оказывающим раздражающего действия, и насухо промокают.
5.2.4.3 Вытяжки и модельные среды
Смачивают соответствующей вытяжкой сложенный вчетверо кусочек марли (0,5 мл на кусочек), прикладывают его к участку кожи с каждой стороны спины животного, как показано на рисунке 1. Контрольный кусочек марли, смоченный модельной средой, помещают на кожу другого участка.
Покрывают места аппликаций полупрозрачной повязкой не менее чем на 4 ч. Затем снимают фиксирующую повязку и отмечают положение участков, удаляют остатки исследуемого вещества подходящими средствами, например теплой водой или другим растворителем, не оказывающим раздражающего действия, и насухо промокают.
5.2.4.4 Твердые материалы
Прикладывают образцы исследуемого материала на кожу спины каждого кролика с каждой стороны позвоночника, как показано на рисунке 1. Подобным образом прикладывают контрольные образцы на кожу спины каждого кролика. Поверхность твердых образцов (которые при необходимости могут быть измельчены) смачивают водой или другим растворителем, что позволяет обеспечить более плотное прилегание образца к коже. Если в опыте используют растворитель, учитывают его влияние на результаты эксперимента.
Покрывают исследуемый образец защитным покрытием размером 25x25 мм (таким как кусочек ткани или марли) и фиксируют места аппликации полупрозрачной повязкой не менее чем на 4 ч. Затем снимают повязку, отмечают положение участков, удаляют остатки исследуемых материалов подходящими средствами, например, теплой водой или другим растворителем, не оказывающим раздражающего действия, и насухо промокают.
5.2.5 Обследование животных
При остром (однократном) воздействии регистрируют состояние каждого участка кожи, где производили аппликации, через 1, 24, 48 и 72 ч после удаления образцов. Более длительное наблюдение (но не более 14 сут) проводят при возникновении стойких изменений кожи для определения их обратимости.
При многократном воздействии регистрируют состояние кожи в месте аппликации через 1 ч после удаления образца и непосредственно перед следующей аппликацией. После последней аппликации регистрируют состояние каждого участка через 1, 24, 48 и 72 ч после снятия образцов. Более длительное наблюдение (но не более 14 сут) проводят при стойких изменениях кожи для определения их обратимости.
Описывают и оценивают степень кожной реакции, включая эритему и отек, в соответствии с классификацией, представленной в таблице 1, для каждого участка и каждого интервала времени наблюдения. Регистрируют результаты в отчете об исследовании.
Таблица 1 - Система классификации кожных реакций
Реакция | Оценка в баллах |
Эритема и образование струпа | |
Отсутствие эритемы | 0 |
Очень слабая эритема (слегка заметная) | 1 |
Заметная эритема | 2 |
Умеренная эритема | 3 |
Выраженная эритема (ярко-красная) с образованием струпа | 4 |
Образование отека | |
Отсутствие отека | 0 |
Очень слабый отек (слегка заметный) | 1 |
Заметный отек, выступающий над поверхностью кожи и имеющий четковыраженные границы | 2 |
Умеренный отек (выступающий над поверхностью кожи около 1 мм) | 3 |
Выраженный отек (распространенный, выступающий над поверхностью | 4 |
Максимально возможное количество баллов | 8 |
Примечание - Другие кожные реакции должны быть зарегистрированы и внесены в отчет об исследовании | |
Примечание - В некоторых случаях могут оказаться полезными гистологические и неинвазивные методы исследования.
5.2.6 Оценка результатов
При остром воздействии определяют индекс первичного раздражения (ИПР), при этом для каждого животного складывают баллы первичного раздражения, вызванного исследуемым материалом, включая отеки и эритемы, в каждый интервал времени наблюдения и делят их на общее число наблюдений (на 6 - по 2 на каждый интервал времени). Если в исследованиях использовался контроль, вычисляют балл первичного раздражения контроля. Для объективности исследований из балла первичного раздражения исследуемого материала вычитают балл первичного раздражения контроля.
Для вычислений используют только данные наблюдений, полученные через 24, 48, 72 ч. Наблюдения, сделанные при определении дозы или позже чем через 72 ч, во внимание не принимают.
Для получения ИПР складывают баллы каждого животного и делят на количество животных.
При многократном воздействии определяют индекс суммарного раздражения, при этом для каждого животного складывают баллы раздражения, включая эритемы и отеки, в каждый интервал времени. Делят полученное число на общее количество наблюдений и получают средний балл раздражения для каждого животного.
Для получения индекса суммарного раздражения складывают средние баллы раздражения всех подопытных животных и делят на количество особей.
Индекс суммарного раздражения сравнивают со значениями, представленными в таблице 2, и регистрируют в отчете об исследовании.
Таблица 2 - Степени ответной реакции на раздражение у кроликов
Ответная реакция | Количество баллов |
Отсутствие | От 0 до 0,4 |
Слабая | " 0,5 " 1,9 |
Умеренная | " 2,0 " 4,9 |
Выраженная | " 5,0 " 8,0 |
Примечание - Индекс суммарного раздражения позволяет экстраполировать результаты определения ИПР на химические вещества у кроликов на человека, учитывая предыдущий опыт исследования ряда химических веществ на обоих видах.
Для каждого случая определяют максимальный ответ на раздражение, фиксируют время, при котором это раздражение возникает, и его продолжительность.
Оценка в баллах и описания, представленные в таблице 2, характеризуют индексы первичного и суммарного раздражения.
5.2.7 Представление результатов
В отчет об исследованиях включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
5.3 Раздражающее действие на глаза
5.3.1 Цель исследования
Оценка потенциальной способности материала оказывать раздражающее действие на слизистую оболочку глаза.
5.3.2 Исключение из исследования
Материалы или изделия, вызвавшие коррозию и сильное раздражение при действии на кожу, исследованиям раздражающего действия на слизистую глаза не подвергают. Вещества, обладающие сильными кислотными или щелочными свойствами (рН меньше или равно 2,5 или больше или равно 11,5) исследованиям на слизистой оболочке глаза не подвергают, так как их свойство вызывать раздражение и коррозию заранее известно. Очевидно, что такие материалы обладают раздражающим действием на слизистую глаза.
5.3.3 Исследуемый материал
Если исследуемый образец представляет собой жидкость, закапывают 0,1 мл в нижний отдел конъюнктивального мешка.
Твердый или гранулированный продукт измельчают до пылеобразного состояния и затем аккуратно вводят в нижний отдел конъюнктивального мешка глаза такое количество материала, которое занимает объем 0,1 мл, но не более 100 мг.
Примечание - Некоторые материалы нельзя исследовать непосредственно на слизистой глаза, так как возникают механические повреждения.
Если исследуемый материал упакован в шприце или тубе и выделяется под действием давления, получают некоторое количество этого вещества и вводят 0,1 мл так же, как для жидких веществ.
Материал в аэрозольной упаковке разбрызгивают в течение 1 с с расстояния 10 см непосредственно на поверхность открытого глаза или впрыскивают в охлажденную емкость и изучают так же, как жидкие продукты.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б и закапывают 0,1 мл вытяжки в нижний конъюнктивальный мешок глаза.
В идентичных условиях готовят контроль с использованием полярных и неполярных растворителей в отсутствии исследуемого вещества.
5.3.4 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых кроликов-альбиносов одной линии обоего пола массой 2-3 кг.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
Для первичной оценки исследуемого материала используют одно животное.
При выраженной реакции, полученной при исследовании на одном животном, дальнейшие исследования не проводят.
Если при исследованиях твердых или жидких материалов не наблюдается выраженной реакции, далее используют не менее двух животных, а при исследовании вытяжек из материалов - не менее двух животных на каждую вытяжку.
Если результаты исследований, полученные не менее чем на трех животных, сомнительны или неясны, проводят дополнительные исследования.
5.3.5 Проведение исследований
Не позднее чем за 24 ч до начала исследований визуально оценивают состояние глаз каждого кролика для выявления выраженных повреждений. При обнаружении патологических изменений хотя бы в одном глазу животное заменяют.
Для более четкого выявления изменения роговицы используют 2%-ный раствор флуоресцеина натрия.
Используют офтальмоскоп, ручную щелевую лампу или другие устройства.
Вводят исследуемый материал, как указано в 5.3.3.
После инстилляции веки соединяют и держат в таком положении в течение 1 с.
Примечание - Другой глаз животного считают интактным контролем.
Если предполагается многократное или длительное воздействие материала и в остром эксперименте исследуемый материал не проявил ярко выраженной реакции, проводят исследование с многократным воздействием на организм. Продолжительность воздействия определяют в соответствии с продолжительностью воздействия материала или изделия на организм при его применении в медицинской практике.
5.3.6 Обследование животных
Оба глаза животного, которому однократно инстиллировали исследуемый материал, осматривают через 1, 24, 48 и 72 ч после воздействия.
Если имеются стойкие изменения, постоянное наблюдение (но не более 21 сут) проводят для оценки их прогрессирования и обратимости. При обнаружении тяжелых повреждений постоянные наблюдения не проводят.
Оценивают и регистрируют любые наблюдаемые реакции в соответствии с классификацией, представленной в таблице 3.
Таблица 3 - Система классификации повреждения глаза
Реакция | Оценка в баллах |
1 Роговица | |
Степень помутнения (площадь поражения) | |
Отсутствие | 0 |
Генерализованное или диффузное помутнение, детали радужной оболочки хорошо различимы | 1* |
Легко различимое полупрозрачное помутнение, детали радужной оболочки замутнены | 2* |
Опалесцирующее помутнение, детали радужной оболочки не различимы, размер зрачка определить невозможно | 3* |
Помутнение светонепроницаемо, радужная оболочка не видна | 4* |
Площадь пораженной роговицы | |
Одна четверть (или менее) | 0 |
Более одной четверти, но меньше половины | 1 |
Более половины, но меньше трех четвертей | 2 |
Более трех четвертей и площадь всего глаза | 3 |
2 Радужная оболочка | |
Нормальная | 0 |
Складчатость выше нормы, заметное набухание, сосуды инъецированы (один или все указанные симптомы), радужная оболочка реагирует на свет (реакция положительная) | 1* |
Реакция на свет отсутствует, увеличение кровоизлияний (один или все симптомы) | 2* |
3 Конъюнктива | |
Краснота (относится к конъюнктиве век и глазного яблока, исключая роговицу и радужную оболочку) | |
Нормальные сосуды | 0 |
Сосуды заметно инъецированы (выше нормы) | 1 |
Более выраженная диффузная краснота, отдельные сосуды плохо различимы | 2* |
Диффузная резко выраженная краснота | 3* |
4 Хемоз (отек конъюнктивы) | |
Отсутствие отека | 0 |
Слегка заметный отек (включая мигательную перепонку) | 1 |
Выраженный отек с частичным выворотом век | 2* |
Отек с половинным закрытием века | 3* |
Отек с закрытием века от половинного до полного | 4* |
5 Выделения | |
Отсутствие выделений | 0 |
Незначительные выделения, отличающиеся от нормальных (не учитывать наличие выделений во внутреннем углу глаза, наблюдаемое и у контрольных животных) | 1 |
Выделения на веках и шерсти вокруг глаз | 2 |
Выделения на веках, шерсти вокруг глаз и значительной площади мордочки | 3 |
* Положительный результат. | |
Животным, которым проводят многократные инстилляции материала, глаза осматривают до, непосредственно после и через 1 ч после каждой процедуры.
Если наблюдается выраженное раздражение после последней процедуры, наблюдение продолжают. Наблюдение продолжают в случае изменений роговицы или других признаков раздражения глаза для оценки прогрессирования и обратимости возникших патологических процессов.
Оценивают и регистрируют любые наблюдаемые реакции в соответствии с классификацией, представленной в таблице 3.
Немедленный вывод животных из эксперимента проводят с использованием гуманных методов умерщвления в следующих случаях:
- тяжелые поражения глаз (такие как изъявление или образование струпа на конъюнктиве, перфорация на роговице, скопление крови и гноя в передней камере глаза);
- выраженная эритема или нагноение;
- серьезные изъязвления роговицы.
Животное выводят из эксперимента при обнаружении максимального в соответствии с системой классификации таблицы 3 действия - отсутствия светового рефлекса (степень поражения радужной оболочки 2) или помутнения роговицы (степень 4) без видимого улучшения в течение 24 ч, или воспаления конъюнктивы (хемоз степени 4 совместно с гиперемией степени 3) - без видимого улучшения через 48 ч с умерщвлением их гуманным методом.
5.3.7 Оценка результатов
Выявленные различия в состоянии исследуемого и контрольного глаза описывают и объясняют, используя классификацию таблицы 3.
5.3.7.1 Острое воздействие
Если при воздействии исследуемого материала в подопытном глазу более чем у одного животного обнаружены патологические изменения (отмеченные в таблице 3 знаком "*"), считают, что материал обладает раздражающим действием и дальнейшие исследования не проводят.
Если патологические изменения выявлены в подопытном глазу только одного из трех кроликов или при сомнительных результатах, исследования повторяют на большем количестве животных.
Если при исследовании на большем количестве животных патологические изменения в подопытном глазу (отмеченные в таблице 3 знаком "*") обнаруживаются более чем у половины кроликов исследуемой группы на любой стадии обследования, считают, что материал обладает раздражающим действием.
При тяжелом поражении глаза даже у одного животного материал считают сильным раздражителем.
5.3.7.2 Многократное или длительное воздействие
Если при многократном воздействии на глаз более чем у половины животных исследуемой группы возникают патологические изменения (отмеченные в таблице 3 знаком "*") на любой стадии обследования, считают, что исследуемый материал обладает раздражающим действием.
5.3.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
5.4 Раздражающее действие при внутрикожном введении
5.4.1 Цель исследований
Оценка способности материала оказывать раздражающее действие при внутрикожном введении.
5.4.2 Исключение из исследования
Материалы, обладающие раздражающим действием на кожу, слизистую глаза или ткани мышц, или рН которых меньше или равно 2 или больше или равно 11,5, исследованиям не подвергают.
5.4.3 Исследуемый материал
Исследованиям подвергают вытяжку из образца, которую готовят в соответствии с приложением Б.
5.4.4 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых кроликов-альбиносов одной линии обоего пола массой не менее 2 кг.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
Для первичной оценки исследуемого материала используют не менее трех кроликов.
При неудовлетворительных или сомнительных результатах, полученных при первичной оценке, проводят дополнительные исследования.
5.4.5 Методика проведения исследований
За сутки до проведения исследования тщательно выстригают шерстный покров на спине животных, оставляя достаточные промежутки между участками кожи, где предполагают произвести инъекции вытяжек.
Внутрикожное введение 0,2 мл вытяжки, приготовленной с использованием полярной модельной среды, производят в пяти участках кожи на одной стороне спины каждого кролика в соответствии с рисунком 2. Для инъекций используют иглы самых маленьких размеров с учетом вязкости вводимых вытяжек.
исунок 2 - Расположение точек внутрикожных инъекций
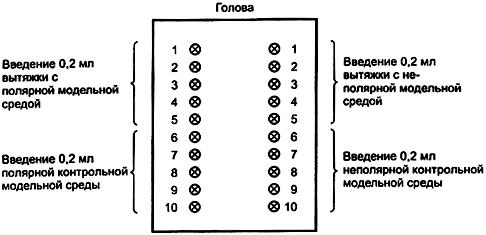
Рисунок 2 - Расположение точек внутрикожных инъекций
Одновременно вводят 0,2 мл полярной контрольной модельной среды в пяти участках кожи с той же стороны спины каждого кролика (рисунок 2).
Описанную выше процедуру повторяют с вытяжкой, приготовленной с использованием неполярной модельной среды, и с неполярной контрольной модельной средой с другой стороны спины каждого кролика (рисунок 2).
Если применяют другие растворители, описанные процедуры повторяют как для вытяжек, приготовленных с их использованием, так и для самих растворителей.
5.4.6 Обследование животных
Отмечают состояние мест инъекции непосредственно сразу, через 24, 48 и 72 ч после введения.
Оценивают степень тканевой реакции, включая эритему и отек, в соответствии с классификацией, представленной в таблице 4, для каждого места инъекции и каждого интервала времени наблюдения и регистрируют результаты.
Таблица 4 - Система классификации местной реакции при внутрикожном введении
Реакция | Оценка в баллах |
Эритема и образование струпа | |
Отсутствие эритемы | 0 |
Очень слабая эритема (слегка заметная) | 1 |
Заметная эритема | 2 |
Умеренная эритема | 3 |
Выраженная эритема (ярко-красная) с образованием струпа | 4 |
Образование отека | |
Отсутствие отека | 0 |
Очень слабый отек (слегка заметный) | 1 |
Заметный отек | 2 |
Умеренный отек (выступающий над поверхностью кожи около 1 мм) | 3 |
Выраженный отек (распространенный, выступающий над поверхностью кожи более чем на 1 мм) | 4 |
Максимально возможное количество баллов | 8 |
Примечание - Другие возникшие в месте инъекции реакции должны быть отмечены в отчете об исследовании | |
Примечание - Внутрикожное введение масляных растворов заведомо вызывает раздражение.
Внутривенное введение соответствующих прижизненных красителей, таких как трипановый синий или Evans blue, сделанное перед последним (72 ч после введения вытяжки) обследованием животных, позволяет лучше оценить реакцию на внутрикожное введение вещества, окрашивая места возникшего раздражения.
Для оценки по возможности применяют методы, наименее травмирующие животных.
5.4.7 Оценка результатов
Определяют индекс первичного раздражения, при этом для каждого животного складывают баллы первичного раздражения, включая эритему и отек, отдельно для каждой исследуемой вытяжки, учитывая каждый интервал времени наблюдения, и делят на общее количество наблюдений. Такие же расчеты производят для участков, на которые воздействуют контрольным раствором. Разность баллов, полученных для исследуемого материала и контрольного раствора, дает балл первичного раздражения, который используют для вычисления индекса первичного раздражения.
Используют наблюдения, полученные только через 24, 48 и 72 ч после введения.
Для получения индекса первичного раздражения (ИПР) складывают баллы первичного раздражения каждого животного и делят на общее число животных.
Таблица 5 - Степени ответной реакции на раздражение у кроликов
Ответная реакция | Количество баллов |
Отсутствие | От 0 до 0,4 |
Слабая | " 0,5 " 1,9 |
Умеренная | " 2,0 " 4,9 |
Выраженная | " 5,0 " 8,0 |
Оценка в баллах и описания, представленные в таблице 5, характеризуют индексы первичного и суммарного раздражения.
5.4.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
6 Исследование сенсибилизирующего действия
Существует несколько методов изучения сенсибилизирующего действия на коже морских свинок. Обычно применяют два метода: метод максимального сенсибилизирующего воздействия (Magnusson & Kigman) и метод закрытых накожных аппликаций (Buehler). Исследования проводят, используя один из этих методов. Метод максимального сенсибилизирующего воздействия в соответствии с 6.2 более чувствителен и является предпочтительным, особенно при оценке вытяжек из материалов и изделий. Перечень альтернативных методов приведен в приложении Д.
6.1 Факторы, которые следует учитывать при выборе метода
При выборе метода учитывают биохимические и физические характеристики исследуемого материала. Метод максимального воздействия требует внутрикожного введения, следовательно, если исследуемый материал нельзя ввести внутрикожно, в качестве альтернативного используют метод накожных аппликаций.
Выбранный растворитель должен повышать чувствительность метода благодаря частичному растворению материала и проникновению в более глубоко лежащие слои. Концентрация исследуемого материала должна быть максимально возможной, но не оказывать влияния на интерпретацию результатов. Важным фактором при местном воздействии является концентрация материала на поверхности кожи, а не его объем. Возможности метода накожных аппликаций будут рассмотрены ниже.
Невозможно избежать повреждения кожи, если внутрикожно вводят адьювант Фрейнда.
Время экспозиции вещества на каждой стадии эксперимента должно способствовать успеху эксперимента. Оно может варьировать для достижения этой цели. Все стадии (предварительная внутрикожная сенсибилизация, фаза местного воздействия, провокационная проба) имеют важное значение, но основной целью является выявление возможной гиперчувствительности замедленного типа. Подсчет баллов на контактирующих с материалом участках кожи не может использоваться для интерпретации результатов.
Расположение подопытных участков кожи на теле морской свинки не является обязательным, важно, чтобы провокационная проба была сделана на совершенно новом (не испытывавшем воздействия) месте.
Сравнение подопытных животных после провокации с животными контрольной группы дает возможность выявить положительную реакцию, при этом тяжесть возникших патологических изменений также имеет значение для интерпретации результатов.
Граница ответной реакции на провокационную пробу становится более заметной при ее затухании. Гистологические исследования необязательны.
Положительные результаты не всегда позволяют запретить применение исследуемого материала или изделия, так как доза вещества во время исследований может быть искусственно завышена по сравнению с количеством, применяемым в медицинской практике. Положительные результаты исследования сенсибилизацирующего действия, использующего одну из рекомендуемых методик, дают основание для проведения дополнительных исследований как на морских свинках, так и на человеческом организме, что представляет определенную опасность. Сенсибилизирующая способность вещества или материала может определяться его минимальной концентрацией, которая способна вызвать сенсибилизирующий эффект. Это, как минимум, вызывает необходимость проверки соответствующих концентраций и носителей.
Повторение исследований с использованием других методик и оценка результатов провокационной пробы позволяет избежать неспецифического действия, что является актуальной научной и практической задачей. Методы с использованием провокационной пробы, которую проводят после аппликаций, позволяют обеспечить безопасность применения изделия или материала.
Практическое применение изделий или материалов, контактирующих с раневой поверхностью или поврежденной кожей и при этом обладающих сенсибилизирующим действием, недопустимо. Однако многие ингредиенты, являющиеся по своей природе потенциальными аллергенами, могут быть использованы в приемлемой концентрации в готовом материале или изделии благодаря своим ценным качествам.
6.2 Метод максимального сенсибилизирующего воздействия
6.2.1 Цель исследования
Оценка возможного сенсибилизирующего действия материала на кожу морских свинок.
6.2.2 Исследуемый материал
Твердые вещества (включая порошки) или жидкость готовят к исследованиям в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б.
6.2.3 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых морских свинок-альбиносов одной линии обоего пола с исходной массой 300-500 г. В эксперименте не используют беременных самок или животных после спаривания.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
Для исследования порошкообразных или жидких материалов используют не менее 10 животных на каждый исследуемый образец и не менее 5 животных составляют контрольную группу. Дополнительное количество животных используют для проведения предварительных исследований.
При исследовании вытяжек также используют не менее 10 животных для каждой вытяжки и не менее 5 морских свинок составляют контрольную группу для каждого раствора. Дополнительное количество животных используют для предварительных исследований.
Примечание - Для выявления слабо выраженного сенсибилизирующего эффекта допускается удвоение количества экспериментальных животных.
6.2.4 Проведение исследования
6.2.4.1 Подготовка
Шерсть на подопытных участках кожи тщательно выстригают за день до начала исследования.
Доза, вводимая внутрикожно в каждый подопытный участок, равна 0,1 мл.
Для всех аппликаций используют кусочки фильтровальной бумаги, пропитанные исследуемым материалом или вытяжкой из него, которые прикладывают на выстриженные участки кожи и фиксируют бинтом вокруг тела животного.
6.2.4.2 Предварительные исследования
Примечание - Предварительные исследования проводят для того, чтобы определить концентрацию исследуемого материала, которая будет использована в основном эксперименте.
Предварительно всем животным вводят адьювант Фрейнда.
Затем двум животным внутрикожно вводят исследуемый материал или вытяжку из него (в выбранном растворителе) определенной концентрации.
Для внутрикожного введения в основном эксперименте берут самую большую концентрацию исследуемого материала, которая не вызывает выраженных изменений кожи и не оказывает общего отрицательного воздействия на животных.
Выборочно проводят аппликации разных концентраций исследуемого материала или вытяжек из него на кожу бока дополнительно еще трем животным. Через 24 ч снимают повязку и образцы и оценивают состояние аппликационных участков на наличие эритемы и отека в соответствии с таблицей 6.
Таблица 6 - Система классификации реакции кожи
Реакция | Оценка в баллах |
Эритема или образование струпа | |
Отсутствие эритемы | 0 |
Очень слабая эритема (слегка заметная) | 1 |
Заметная эритема | 2 |
Умеренная эритема | 3 |
Выраженная эритема (ярко-красная) с образованием струпа | 4 |
Образование отека | |
Отсутствие отека | 0 |
Очень слабый отек (слегка заметный) | 1 |
Заметный отек | 2 |
Умеренный отек | 3 |
Выраженный отек | 4 |
Примечания | |
Определяют:
а) если возможно, для фазы местного воздействия в основном эксперименте - наивысшую концентрацию исследуемого материала, которая вызывает легкую эритему, но не оказывает общего отрицательного влияния на организм животных;
б) для фазы провокационной пробы в основном эксперименте - наивысшую концентрацию, которая не вызывает эритемы.
6.2.4.3 Основной эксперимент
6.2.4.3.1 Внутрикожная предварительная сенсибилизация
Каждому животному в выстриженные участки кожи (1, 2 и 3) в соответствии со схемой рисунка 3 проводят парные внутрикожные инъекции по 0,1 мл нижеперечисленных растворов:
- смесь адьюванта Фрейнда с выбранным растворителем в соотношении =50/50. Растворителем может быть вода или физиологический раствор (в соответствии с Государственной Фармакопеей СССР, Британской Фармакопеей, Фармакопеей США) для водорастворимых материалов. Для нерастворимых в воде материалов примерный список растворителей приведен в приложении Б (Б.2.10);
- исследуемый материал или вытяжку из него в концентрации, которая определена в предварительном эксперименте; контрольным животным вводят только растворитель;
- исследуемый материал или вытяжку из него в концентрации, которая определена в предварительном эксперименте, смешивают с полным адьювантом Фрейнда и растворителем, взятыми в соотношении = 50/50; контрольным животным вводят только растворитель, смешанный с адьювантом.
Рисунок 3 - Расположение точек внутрикожных инъекций
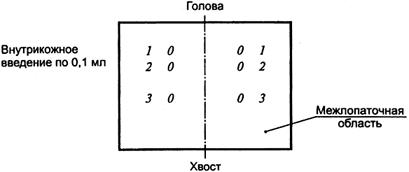
Рисунок 3 - Расположение точек внутрикожных инъекций
6.2.4.3.2 Фаза местного воздействия
Через семь дней после внутрикожного введения начинают накожные аппликации исследуемого материала или вытяжки из него на спину в области лопаток каждого животного, используя для этого пропитанные материалом или вытяжкой кусочки фильтровальной бумаги размером 20x40 мм. При этом используют концентрацию согласно 6.2.4.2а и соответствующую фиксирующую повязку. Повязку и кусочки фильтров удаляют через (48±2) ч.
Процедуру с контрольными животными повторяют в том же режиме, используя только растворитель.
Если максимальная концентрация, которая получена в соответствии с 6.2.4.2а, не вызывает раздражения, проводят обработку участка 10%-ным раствором лаурилсульфата натрия в вазелине за (24±2) ч до начала местных аппликаций. С контрольными животными поступают подобным образом.
6.2.4.3.3 Провокационная проба
Через 14 дней после фазы местного воздействия проводят провокационную пробу исследуемого материала или вытяжки с подопытными и контрольными животными. Для этого делают аппликации исследуемого материала или вытяжки на кожу бока каждого животного, используя соответствующие кусочки фильтров, пропитанные исследуемым материалом или вытяжкой из него в концентрации согласно 6.2.4.2б, и фиксирующие повязки. Повязку и кусочки фильтров снимают через (24±2) ч.
Примечание - Допускается проводить аппликации раствора с уменьшенной концентрацией на другие участки кожи по той же методике.
6.2.5 Обследование животных
Осматривают поверхность участков, где проводили провокационную пробу подопытных и контрольных животных, через 24, 48, 72 ч после снятия повязки.
Описывают и оценивают степень кожной реакции, включая эритему и отек, в соответствии с таблицей 6 для каждого участка и в каждый интервал времени наблюдения.
6.2.6 Оценка результатов
Если оценка в баллах, полученная в подопытной группе, равна 1 или выше, о наличии сенсибилизации говорят в том случае, если у контрольных животных этот показатель менее 1. Если оценка в баллах у контрольных животных равна 1 или выше, то реакция кожи подопытных животных, которая превышает самую сильную реакцию, наблюдаемую в контроле, является результатом сенсибилизации.
Иногда в подопытной группе у большего, чем в контроле, числа животных выявлен сенсибилизирующий эффект, однако интенсивность реакции не выше, чем у контрольных животных. В этом случае проводят дополнительную провокационную пробу с целью получить более четкий ответ организма. При необходимости дополнительную провокационную пробу проводят приблизительно через 7 дней после первой провокации. При этом применяют описанный выше метод, используя другой бок животного.
6.2.7 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
6.3 Метод закрытых накожных аппликаций
6.3.1 Цель исследования
Оценка возможного сенсибилизирующего действия материала на кожу морских свинок.
6.3.2 Исследуемый материал
Если исследуемый образец представляет собой раствор или жидкость, его готовят в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, то ее готовят в соответствии с приложением Б.
6.3.3 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых морских свинок-альбиносов одной линии обоего пола с исходной массой 300-500 г. В эксперименте не используют беременных самок или животных после спаривания.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
Для исследования твердых, порошкообразных или жидких материалов используют не менее 10 животных на каждый исследуемый материал и не менее 5 животных составляют контрольную группу. Дополнительное количество животных используют для проведения предварительных исследований.
При исследовании вытяжек также используют не менее 10 животных для каждой вытяжки и не менее 5 животных составляют контрольную группу для каждого раствора. Дополнительное количество животных используют для предварительных исследований.
Примечание - Для выявления слабо выраженного сенсибилизирующего эффекта допускается удвоенное количество экспериментальных животных.
6.3.4 Проведение исследования
6.3.4.1 Подготовка
Шерсть на подопытных участках кожи тщательно выстригают за день до начала эксперимента. Для местных аппликаций пропитывают исследуемым материалом или экстрактом кусочки ткани или перевязочного материала соответствующих размеров, прикладывают эти кусочки к выстриженному участку и фиксируют повязкой на 6 ч.
Чтобы обеспечить плотное прилегание исследуемого образца к коже, его прикрепляют с помощью бинта либо фиксируют животное.
Следует учесть, что перевязка является дополнительным стрессовым фактором, влияющим на результаты эксперимента.
6.3.4.2 Предварительные исследования
Примечание - Предварительные исследования проводят для того, чтобы определить концентрацию исследуемого материала или вытяжки из него, которая будет использована в основном эксперименте в соответствии с 6.3.4.3.
Проводят местную аппликацию четырех концентраций исследуемого материала или вытяжки из него на бок каждого из трех животных, используя соответствующие кусочки ткани. Кусочки ткани и фиксирующую повязку снимают через 6 ч. Подопытные участки кожи оценивают на наличие эритемы и отека в соответствии с таблицей 6 через 24 и 48 ч после снятия образцов.
Выбирают:
- для фазы воздействия в основном эксперименте - наивысшую концентрацию, которая вызывает легкую эритему, но не оказывает общего отрицательного влияния на организм животного;
- для фазы провокационной пробы в основном эксперименте - наивысшую концентрацию, которая не вызывает эритемы.
6.3.4.3 Основной эксперимент
6.3.4.3.1 Основные положения
Используют не менее 10 животных в подопытной и не менее 5 животных в контрольной группе. Если реакция организма на используемый растворитель неизвестна, добавляют соответствующую контрольную группу для растворителя.
6.3.4.3.2 Фаза воздействия
Проводят местную аппликацию исследуемого материала или вытяжки из него на выстриженные участки кожи левой верхней части спины каждого животного, используя пропитанные исследуемым материалом или вытяжкой из него в концентрации, определенной по 6.3.4.2а, кусочки ткани. Фиксирующую повязку и пропитанные кусочки ткани снимают через 6 ч.
Указанную процедуру повторяют в течение трех недель с интервалами в одну неделю. Может быть проведена дополнительная аппликация.
Контрольным животным проводят подобные аппликации в том же режиме, используя при этом только растворитель.
6.3.4.3.3 Провокационная проба
Через 14 дней после последней аппликации у подопытных и контрольных животных проводят провокационную пробу с исследуемым материалом или вытяжкой из него. Провокационную пробу проводят способом однократной местной аппликации на выстриженный, не испытывавший ранее воздействия участок кожи каждого животного, используя соответствующие пропитанные исследуемым материалом или вытяжкой из него в концентрации согласно 6.3.4.2б кусочки ткани. Фиксирующую повязку и кусочки ткани снимают через 6 ч.
6.3.5 Обследование животных
Через (24±2) ч после первой или второй провокационной пробы производят:
- удаление шерсти у всех животных на подопытных участках и окружающей их коже с помощью депилятора, имеющегося в продаже, в соответствии с прилагаемой к нему инструкцией или
- выбривание шерсти у всех животных на подопытных участках и окружающей их коже.
Тщательно смывают депилятор теплой водой и сушат кожу полотенцем перед возвращением животных в клетки. Не менее чем через 2 ч после описанной выше процедуры удаления шерсти оценивают состояние исследуемых участков в соответствии с таблицей 7. Осмотр повторяют через (48±2) ч после провокационного воздействия.
Таблица 7 - Система классификации реакций кожи
Реакция | Оценка в баллах |
Эритема и образование струпа | |
Отсутствие эритемы | 0 |
Очень слабая эритема (слегка заметная) | 1 |
Заметная эритема | 2 |
Умеренная эритема | 3 |
Выраженная эритема (ярко-красная) с образованием струпа | 4 |
Образование отека | |
Отсутствие отека | 0 |
Очень слабый отек (слегка заметный) | 1 |
Заметный отек | 2 |
Умеренный отек | 3 |
Выраженный отек | 4 |
Примечания | |
Примечание - Для удобства регистрации первая и вторая оценки состояния кожи после провокационных проб обозначены соответственно как 24- и 48-часовая.
6.3.6 Оценка результатов
Если оценка в баллах, полученная в подопытной группе, равна 1 или выше, о наличии сенсибилизации говорят в том случае, если у контрольных животных этот показатель менее 1. Если оценка в баллах у контрольных животных равна 1 или выше, то реакция кожи подопытных животных, которая превышает самую сильную реакцию, наблюдаемую в контроле, является результатом сенсибилизации.
Иногда в подопытной группе у большего, чем в контроле числа животных, наблюдается сенсибилизирующий эффект, однако при этом интенсивность реакции может быть не выше, чем у контроля. В этом случае проводят дополнительную провокационную пробу с целью выявить ответ организма более четко. При необходимости дополнительную провокационную пробу проводят приблизительно через 7 сут после первой провокации. При этом применяют описанный выше метод, только используют другой бок животного.
6.3.7 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
ПРИЛОЖЕНИЕ А (обязательное). Подготовка образцов
ПРИЛОЖЕНИЕ А
(обязательное)
А.1 Общие положения
При изучении раздражающего и сенсибилизирующего действия и интерпретации результатов учитывают свойства исследуемого материала или изделия, продолжительность, частоту, способ и степень его контакта с организмом. Одним из важных условий проведения исследований является подготовка исследуемого образца.
Примечание - Общее руководство по подготовке образцов приведено в ГОСТ Р ИСО 10993.12, однако приготовление вытяжек для изучения раздражающего и сенсибилизирующего действия имеет свои особенности.
А.2 Непосредственный контакт
А.2.1 Твердые материалы, имеющие подходящую форму (лист, пленка и т.д.), исследуют, не подвергая изменениям.
А.2.2 Порошки (например суперабсорбенты) исследуют при непосредственном нанесении или после приготовления из них пасты с использованием подходящего растворителя.
А.2.3 Жидкости исследуют или непосредственно, не подвергая изменениям, или в виде растворов с использованием подходящего растворителя, при этом параллельно со смешанным, растворенным или суспензированным исследуемым материалом в качестве контрольного раствора используют этот растворитель.
А.2.4 Из твердых материалов готовят образцы размером 25x25 мм. Толщина образца зависит от толщины исследуемого изделия, но не должна превышать 5 мм. Отрицательный контроль готовят также. Твердый материал может быть измельчен, если при этом полностью сохраняются его свойства, или в достаточной степени увлажнен водой или подходящим растворителем, не обладающим раздражающим действием, что обеспечивает более тесный контакт материала с кожей. Керамические материалы измельчают, однако следует помнить, что физико-химические свойства керамики меняются при ее переходе в порошкообразное состояние.
Отрицательный контроль должен иметь сходные с исследуемым материалом физические параметры и не оказывать раздражающего действия. В качестве заменителя обычно используют марлю, сложенную вчетверо.
А.2.5 Для материалов, которые требуют растворения, суспензирования или смачивания, подбирают растворитель, который не обладает раздражающим действием. Применяемые растворители приведены в приложении Б.
А.2.6 Раздражающее действие твердых материалов изучают так же, подвергая исследованию вытяжки из них. Вытяжки готовят, используя полярные, неполярные и (или) другие подходящие растворители (приложение Б).
Параллельно с вытяжкой из исследуемого материала в качестве контроля используют экстрагирующий растворитель.
А.2.7 Если изделие поступает в продажу стерильным, то перед изучением исследуемый материал подвергают стерилизации тем же методом. Существуют определенные трудности при исследовании образцов, стерилизованных окисью этилена, поскольку окись этилена и продукты ее деструкции могут оказывать биологическое действие в исследованиях, рекомендованных настоящим стандартом. При обнаружении любого неблагоприятного воздействия на организм проводят исследования, позволяющие дифференцировать, вызвана ли обнаруженная реакция действием самого изучаемого материала или она обусловлена остаточным количеством окиси этилена. Если выявлено первичное раздражающее действие, образец исследуют до и после стерилизации окисью этилена.
ПРИЛОЖЕНИЕ Б (обязательное). Методы получения вытяжек из образцов
ПРИЛОЖЕНИЕ Б
(обязательное)
Б.1 Введение
Для проведения биологических исследований изделий в некоторых случаях готовят вытяжки из них, используя соответствующие модельные среды.
Эта процедура включает методы, которые используют для получения вытяжек, предназначенных для дальнейших исследований, и она может служить дополнением, но не заменяет методы, содержащиеся в специальных руководствах.
Б.2 Аппаратура
Б.2.1 Автоклав, работающий в режиме (121±2) °С.
Б.2.2 Печь или термостат с режимом работы до (70±2) °С.
Б.2.3 Печь или термостат с режимом работы до (50±2) °С.
Б.2.4 Термостат с режимом работы до (37±2) °С.
Б.2.5 Режущие инструменты (ножницы, скальпели, пилки).
Для очистки металлических частей режущих инструментов следует применять такие органические растворители как спирт или ацетон. Кислоту для этого применять нельзя.
Б.2.6 Пипетки объемом 1, 5, 10 и 25 мл.
Б.2.7 Весы с погрешностью взвешивания 0,1 г.
Б.2.8 Средства измерения линейных размеров - линейка с миллиметровой шкалой и штангенциркуль.
Б.2.9 Сосуды для экстракции:
- пробирки из боросиликатного стекла с завинчивающейся пробкой из инертного материала (например тефлон PTFE);
- другие удобные стеклянные емкости или сосуды для экстракции.
Используемая химическая посуда не должна оказывать влияния на вытяжку из исследуемого материала.
Б.2.10 Модельные среды:
- полярные растворители - физиологический раствор;
- неполярные растворители - растительные масла, например хлопковое, соевое (Государственная Фармакопея СССР, Европейская Фармакопея, Американская Фармакопея); нейтральные масла (DAC, Fract. Coconut, Государственная Фармакопея СССР, Британская Фармакопея-73);
- другие подходящие модельные среды - этанол/вода, этанол/солевой раствор, полиэтиленгликоль-400, диметилсульфоксид, ацетон, метанол, хлороформ, растворы поверхностно-активных веществ, минеральные масла.
Примечание - Методы получения вытяжек с помощью растворителя могут быть использованы при изучении сенсибилизирующего действия.
Б.3 Приготовление проб
Б.3.1 Определение площади поверхности
Площадь поверхности вычисляют для образцов простой геометрической или близкой к ней формы. Пористые материалы (марля, тканые или губчатые изделия) измеряют как твердые объекты.
Если толщина образца менее 0,5 мм, используют образец площадью поверхности 120 см. Экстракцию проводят в 20 мл модельной среды, при этом вся поверхность образца должна быть покрыта модельной средой.
Примечание - Отношение площади поверхности к объему модельной среды 6:1.
Если толщина образца более 0,5 мм, используют образец площадью поверхности 60 см. Экстракцию проводят в 20 мл модельной среды, при этом вся поверхность образца должна быть покрыта модельной средой.
Примечание - Отношение площади поверхности к объему модельной среды 3:1.
Б.3.2 Масса
Для образцов неопределенной формы, площадь поверхности которых невозможно определить, используют образец массой от 2 до 4 г на 20 мл модельной среды. Взвешивание производят с погрешностью не более 0,1 г.
Б.3.3 Другие материалы
Если характеристики образцов таковы, что указанный объем модельной среды не покрывает необходимую площадь поверхности или массу гомогенного разделяемого образца (например, вспененные или губчатые изделия), используют максимальное количество образца, которое может быть полностью покрыто указанным объемом модельной среды. Затем определяют площадь поверхности или массу (с точностью до 0,1 г) взятого образца материала.
Для материалов с высокой абсорбционной способностью (суперабсорбенты) стандартных методов не существует.
Б.3.4 Неразделяемые материалы
Если при разделении образцов происходит изменение свойств, характеристик или целостности материала и расчетное количество модельной среды не покрывает образец полностью (например сложные изделия, металлические предметы, внутренние поверхности емкостей), используют минимальное количество модельной среды, которое полностью покроет исследуемые поверхности. В зависимости от типа материала указывают либо массу с погрешностью не более 0,1 г, либо площадь поверхности (с погрешностью не более 1 см), также регистрируют объем модельной среды с погрешностью не более 1 мл.
Б.3.5 Заключительная подготовка
Б.3.5.1 Проверяют образец на наличие пыли и посторонних частиц. Промывают и высушивают его, если поверхность исследуемого образца загрязнена или это предусмотрено. Заливают образец чистой водой или водой для инъекций (Государственная Фармакопея СССР, Британская Фармакопея, Американская Фармакопея), используя примерно 70 мл воды на каждые 60 см площади поверхности, взбалтывают в течение 30 с и затем сливают. При необходимости повторяют эту процедуру и затем высушивают исследуемый образец перед экстракцией.
Примечание - Большинство изделий выпускают стерильными и (или) в чистой упаковке, поэтому такая обработка не требуется, она может оказать влияние на результаты исследований. Если нужно реально оценить производственный процесс или выпускаемый материал, указанную выше процедуру не проводят.
Б.3.5.2 После того как точное количество материала вычислено, образец, если возможно, разрезают на маленькие кусочки.
Б.3.5.3 Если толщина материала больше 1 мм и разделить его невозможно, вычисляют площадь поверхности всех частей образца и определяют необходимое для исследования количество.
Б.4 Экстрагирование
Б.4.1 Помещают исследуемый образец в сосуд для экстракций соответствующего размера. Отмеряют нужный объем модельной среды пипеткой или другими измерительными средствами с точностью до 1 мл, заливают им исследуемый образец. Встряхивают образцы, чтобы убедиться, что частицы материала не слиплись.
Б.4.2 Выбирают температуру и время экстракции, исходя из свойств материала и требований к нему. Температура 37 °С и время 72 ч подходят для большинства материалов и изделий.
Более короткий временной период используют в сочетании с более высокой температурой экстракции. При изменении режима экстракции в отчете об исследовании приводят обоснование этого. Оптимальные варианты времени и температуры экстракции приведены в таблице Б.1.
Таблица Б.1 - Оптимальные режимы экстракции
Температура, °С | Время, ч |
121 | 1±0,2 |
70 | 24±2 |
50 | 72±2 |
В ГОСТ Р ИСО 10993.12 приведено обоснование выбора оптимальной температуры экстракции.
Б.4.3 Контрольный раствор готовят без исследуемого образца в химической посуде для экстракции, обрабатывая его тем же способом (температура и время), что и исследуемую вытяжку.
Б.4.4 После экстракции сосуды встряхивают, содержимое переливают в чистую посуду. Вытяжки хранят при комнатной температуре и используют в течение 24 ч. Если вытяжки хранятся при комнатной температуре более 24 ч, их сохранность в этих условиях хранения должна быть подтверждена.
Б.4.5 Для изучения сенсибилизирующего действия полимерных материалов может быть рекомендован другой альтернативный метод экстракции, при этом для получения вытяжек используют летучие растворители, затем вытяжку выпаривают и остаток используют для накожных аппликаций животным.
ПРИЛОЖЕНИЕ В (обязательное). Выбор и содержание экспериментальных животных
ПРИЛОЖЕНИЕ В
(обязательное)
Следующие положения относятся ко всем видам исследований, приведенным в настоящем стандарте.
B.1 В экспериментальных исследованиях используют молодых здоровых половозрелых животных одной линии и желательно из одного известного источника.
В.2 Животных помещают в клетки группами или индивидуально. Содержание группами более предпочтительно.
В.3 Животных помещают таким образом, чтобы они имели свободный доступ к пище и воде.
В.4 Животных акклиматизируют в условиях лаборатории не менее 5 дней до начала эксперимента.
В зависимости от конкретных условий этот период может быть больше.
В.5 Учитывают все правила, касающиеся содержания, ухода и использования экспериментальных животных.
ПРИЛОЖЕНИЕ Г (справочное). Дополнительные методы исследования раздражающего действия
ПРИЛОЖЕНИЕ Г
(справочное)
В отличие от методов изучения раздражающего действия на кожу и слизистую глаза методы исследования раздражающего действия на пенис, влагалище и слизистую полости рта не имеют широкого распространения. Эти методы исследования являются специфическими, считаются дополнительными и не заменяют основные. Они рекомендуются для медицинских изделий, имеющих соответствующее специфическое применение.
Представленный ниже метод исследования раздражающего действия на слизистую полости рта менее травматичен по сравнению с методом, при котором исследуемый материал хирургически имплантируют в защечный мешок хомяка.
Г.1 Раздражающее действие на полость рта
Г.1.1 Цель исследования
Оценка возможного раздражающего действия материалов на ткани ротовой полости.
Г.1.2 Исключение из исследования
Материалы, вызывающие раздражение кожи и слизистой глаза, или рН которых менее или равно 2 или более или равно 11,5, исследованиям не подвергают и признают потенциальными раздражителями ротовой полости.
Г.1.3 Исследуемый материал
Исследуемый образец готовят в соответствии с приложением А.
Жидкие материалы исследуют, пропитывая ими ватные шарики или непосредственно нанося на поверхность слизистой защечного мешка.
Твердые материалы исследуют, непосредственно помещая кусочки (шарики) исследуемого образца или ватные шарики, пропитанные вытяжкой из образца, приготовленной в соответствии с приложением Б, на слизистую защечного мешка.
Г.1.4 Экспериментальные животные и их содержание
Используют молодых здоровых половозрелых сирийских хомячков инбредной линии обоего пола.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
На каждого хомячка надевают воротник шириной 3-4 мм, располагающийся вокруг шеи так, чтобы не мешать нормальному питанию и дыханию, но препятствовать выталкиванию шарика изо рта. Взвешивают животных ежедневно в течение 7 дней. Следят за весом каждого животного и, если необходимо, поправляют воротник. Если животное сильно теряет в весе, его исключают из опыта.
Для первичной оценки исследуемого материала используют не менее трех хомячков.
Примечание - Дополнительно могут быть использованы животные, подвергаемые воздействию отрицательного контроля или контрольного раствора.
При неудовлетворительных или сомнительных результатах, полученных при первичной оценке, проводят дополнительные испытания.
Г.1.5 Проведение исследований
Снимают с каждого животного воротник и выворачивают защечный мешок. После промывания защечного мешка физиологическим раствором обследуют его слизистую на наличие изменений.
Твердые образцы в виде таблеток или шариков диаметром не более 5 мм помещают непосредственно в защечный мешок. Жидкостями или вытяжками пропитывают ватные шарики, регистрируют используемый при этом объем и помещают в один защечный мешок каждого животного. Вместо этого можно просто наполнить защечный мешок жидкостью. Другой защечный мешок без образца является контролем. Если исследованиям подвергают вытяжки, параллельно исследуют соответствующий контрольный раствор.
Снимают воротник и возвращают животных обратно в клетку.
Продолжительность контакта с материалом зависит от реального времени воздействия изделия при применении в медицинской практике, но не должна превышать 5 мин. После воздействия снимают воротник, удаляют ватный тампон и промывают защечный мешок физиологическим раствором, стараясь не загрязнить второй мешок. При остром воздействии указанную процедуру повторяют каждый час в течение 4 ч.
При многократном воздействии число аппликаций, их продолжительность и интервалы между аппликациями зависят от особенностей применения изделия в медицинской практике.
Г.1.6 Обследование животных
Макроскопическое исследование защечных мешков проводят непосредственно после извлечения таблетки или шарика и перед следующей аппликацией, если она необходима. Оценивают состояние слизистой защечных мешков каждого животного в каждый интервал времени наблюдения и определяют степень реакции в соответствии с таблицей Г.1. Регистрируют результаты в отчете об исследовании.
Таблица Г.1 - Система классификации реакции тканей ротовой полости и пениса
Реакция | Оценка в баллах |
Эритема и образование струпа | |
Отсутствие эритемы | 0 |
Очень слабая эритема (слегка ощутимая) | 1 |
Хорошо различимая эритема | 2 |
Эритема средней степени | 3 |
Резко выраженная эритема (темно-красная) с образованием струпа | 4 |
Примечание - Другие возникшие реакции в тканях должны быть отмечены в отчете об исследовании. | |
Через 24 ч последнего воздействия макроскопически исследуют защечные мешки, забивают животных гуманными методами и берут образцы тканей с соответствующих участков защечного мешка. Помещают их в соответствующий фиксатор перед обработкой для гистологических исследований.
Г.1.7 Оценка результатов
Г.1.7.1 Макроскопическое исследование
Сравнивают состояние слизистой подопытных защечных мешков с защечными мешками на противоположной стороне и, если это предусмотрено, с защечными мешками животных контрольной группы.
Баллы (таблица Г.1) каждого наблюдения складывают и делят на общее число наблюдений, чтобы получить среднее значение на одно животное.
Примечания
1 Эти наблюдения могут быть полезны для гистологических исследований.
2 Результаты предварительного осмотра, проведенного до первой аппликации исследуемой пробы, не включают в подсчет баллов.
Г.1.7.2 Гистологические исследования
Раздражающее действие на ткани ротовой полости оценивают патоморфологи. Патоморфологи определяют состояние тканей в соответствии с системой классификации, представленной в таблице Г.2.
Таблица Г.2 - Система классификации микроскопических исследований реакции тканей при воздействии на ротовую полость, пенис, вагину
Реакция | Оценка в баллах | |
1 Эпителий | 0 | |
Нормальный, интактный | 1 | |
Клеточная дистрофия или уплощение | 2 | |
Метаплазия | 3 | |
Локальная эрозия | 4 | |
Генерализованная эрозия | ||
2 Лейкоцитарная инфильтрация | ||
Отсутствие | 0 | |
Минимальная - менее 25 | 1 | |
Слабая - от 25 до 50 | 2 | |
Средняя - от 50 до 100 | 3 | |
Значительная - более 100 | 4 | |
3 Закупорка сосудов | ||
Отсутствие | ||
Минимальная | ||
Слабая | ||
Средняя | ||
Значительная с некрозом сосудов | ||
4 Отек | ||
Отсутствие | ||
Минимальный | ||
Слабый | ||
Средний | ||
Значительный | ||
Индекс раздражающего действия | ||
Средний балл | Прилагаемое описание | |
0 | Отсутствие | |
1 до 4 | Минимальный | |
5 до 8 | Слабый | |
9 до 11 | Средний | |
12 до 16 | Значительный | |
Примечания | ||
Баллы, полученные при микроскопическом исследовании всех животных в подопытной группе, суммируют и делят на число наблюдений для определения среднего значения в группе. Те же вычисления повторяют для контрольной группы. Максимальное значение может достигать 16.
Общее количество баллов больше девяти, полученное при микроскопическом исследовании контрольных защечных мешков, у подопытной группы может указывать на скрытые патологические процессы, а у контрольных животных - на травмирование их при обследовании. В каждом случае повторное исследование проводят, если другое исследование или другие контрольные животные дают такие же высокие баллы.
Разность средних баллов, полученных для подопытных и контрольных групп, дает индекс раздражения.
При оценке результатов многократного воздействия таблицу Г.2 модифицируют, включив в нее дополнительные показатели реакции тканей, связанные с оценкой хронического раздражения.
Г.1.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
Г.2 Раздражающее действие на пенис кроликов
Г.2.1 Основная цель
Оценка возможного раздражающего действия материала при воздействии на пенис кроликов.
Г.2.2 Исключение из исследований
Материалы, обладающие раздражающим действием на кожу и слизистую глаза, или рН которых меньше или равно 2 или больше или равно 11,5, исследованиям не подвергают и признают потенциальными раздражителями.
Г.2.3 Исследуемый материал
Твердые вещества (включая порошки) или жидкость готовят к исследованиям в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б.
Г.2.4 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых самцов кроликов-альбиносов весом не менее 2 кг или морских свинок весом 300-500 г.
Акклиматизацию и уход за животными осуществляют в соответствии с приложением В.
Длина пениса должна быть не менее 1 см.
Так как существуют индивидуальные различия в пигментации, животных осматривают перед первой аппликацией исследуемого материала. Для оценки степени реакции используют систему классификации, приведенную в таблице Г.1. Животных, имеющих значительные изменения цвета кожи или эритему 2 балла или выше, исключают из эксперимента.
Для первичной оценки исследуемого материала в подопытную и контрольную группы берут по три особи.
При неудовлетворительных или сомнительных результатах, полученных при первичной оценке, проводят дополнительные исследования.
Г.2.5 Проведение исследований
Животных помещают на спину, фиксируют конечности.
Осторожно надавливая указательным и средним пальцами на генитальную область, извлекают пенис.
Наносят достаточное количество (приблизительно 0,2 мл) исследуемой пробы так, чтобы пенис был покрыт полностью.
Позволив органу втянуться в складку, изолируют исследуемый участок между передними и задними лапками свободной трикотажной повязкой (марлевым бинтом или нейлоновым чулком), закрепив ее на туловище, что позволяет предотвратить слизывание исследуемого материала и влияние других факторов на проявление реакции раздражения.
Другой возможный способ - помещение животного в специально приспособленное устройство, где оно остается в течение 1 ч после аппликации, а затем возвращение его в клетку.
В остром эксперименте эту процедуру повторяют каждый час в течение 4 ч.
В хроническом эксперименте число аппликаций, их продолжительность и интервалы между аппликациями зависят от особенностей применения изделия в медицинской практике.
Г.2.6 Обследование животных
При остром воздействии отмечают состояние кожи пениса через 1 ч после первой аппликации (т.е. непосредственно перед следующей) и далее после каждой следующей аппликации. Отмечают и регистрируют состояние кожи пениса через 1, 24 и 48 ч после последней аппликации.
При длительном многократном воздействии состояние пениса оценивают через 1 ч после первой аппликации и непосредственно перед каждым последующим воздействием.
Оценивают степень реакции кожи на наличие эритемы в соответствии с системой классификации, приведенной в таблице Г.1, для каждого животного и каждого интервала времени наблюдения и регистрируют результаты в отчете об исследовании.
Если у какого-либо животного обнаружена эритема до первой аппликации, то баллы, которыми оценено это состояние кожного покрова, вычитают из баллов возникшей в результате воздействия эритемы, чтобы определить баллы эритемы, появившейся только под воздействием материала.
Г.2.7 Оценка результатов
Г.2.7.1 Макроскопическое исследование
Сравнивают состояние пениса и его оболочки у подопытных и контрольных животных.
Баллы (таблица Г.1) каждого наблюдения складывают и делят на общее число наблюдений, чтобы получить среднее значение на одно животное.
Примечания
1 Эти наблюдения могут быть полезны для гистологических исследований.
2 Результаты предварительного осмотра, проведенного до первой аппликации исследуемой пробы, не включают в подсчет баллов.
Через 48 ч после последней аппликации животных забивают, используя гуманные методы. Дистальный участок пениса и оболочки иссекают и помещают в соответствующий фиксатор перед обработкой для гистологических исследований.
Г.2.7.2 Гистологические исследования
Раздражающее действие на кожу пениса оценивают патоморфологи. Патоморфологи определяют состояние тканей в баллах в соответствии с системой классификации, представленной в таблице Г.2.
Баллы, полученные при микроскопическом исследовании всех животных подопытной группы, суммируют и делят на число наблюдений, чтобы определить средний балл в группе. Максимальное значение может достигать 16.
Те же вычисления повторяют для контрольной группы.
Общее число баллов большее девяти, полученное при микроскопическом исследовании у контрольных животных, свидетельствует о наличии травмы. Повторное исследование проводят, если другое исследование или контрольные животные дают такие же высокие баллы.
Разность средних баллов, полученных для подопытных и контрольных групп, дает индекс раздражения.
При оценке результатов длительного многократного воздействия таблицу Г.2 модифицируют, включив в нее дополнительные показатели реакции тканей, связанные с оценкой хронического раздражения.
Г.2.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
Г.3 Раздражающее действие на прямую кишку
Г.3.1 Цель исследования
Оценка возможного раздражающего действия исследуемого материала на прямую кишку.
Г.3.2 Исключение из исследования
Материалы, обладающие раздражающим действием на кожу и слизистую глаза, или рН которых меньше или равно 2 или больше или равно 11,5, исследованиям не подвергают и признают потенциальными раздражителями.
Г.3.3 Исследуемый материал
Твердые вещества (включая порошки) или жидкость готовят к исследованиям в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б.
Г.3.4 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых кроликов-альбиносов обоего пола весом не менее 2 кг. Использование животных других видов обосновывают.
Акклиматизацию и уход за животными осуществляют в соответствии с приложением В.
Для первичной оценки исследуемого материала в подопытную и контрольную группу берут по три особи.
При неудовлетворительных или сомнительных результатах, полученных при первичной оценке, проводят дополнительные исследования.
Животных перед экспериментом и перед каждым воздействием обследуют для выявления возможных повреждений прямой кишки: опухолей, раздражения, связанного с инфекционными заболеваниями и т.д.
Г.3.5 Проведение исследований
Короткий (6 см) мягкий катетер или канюлю с тупым концом присоединяют к шприцу объемом 2 мл и более и заполняют шприц с катетером таким образом, чтобы количество исследуемого раствора не превышало 2 мл. Для каждого животного используют индивидуальный шприц с катетером.
Фиксируют животное с помощью удерживающего приспособления, которое обеспечивает свободный доступ к промежности, или с помощью лаборанта, осторожно удерживающего животное и фиксирующего его за задние конечности таким образом, чтобы открыть промежность.
Катетер перед введением смачивают контрольным раствором или специальной смазкой для облегчения ввода в кишку.
Захватывают и поднимают хвост животного, открывая промежность. Мягко вводят катетер глубоко в прямую кишку и впрыскивают 2 мл жидкости из шприца, затем катетер вынимают.
Поскольку объем прямой кишки у животных неодинаков, исследуемый материал может частично выйти из нее во время или сразу после введения. Аккуратно удаляют остатки материала мягкой тканью.
Повторяют вышеописанную процедуру через 24 ч ежедневно в течение 5 сут.
В хроническом эксперименте число аппликаций, их продолжительность и интервалы между аппликациями зависят от особенностей применения изделия в медицинской практике.
Г.3.6 Обследование животных
Через 24 ч после первой аппликации и непосредственно перед следующей отмечают и регистрируют появление изменений внешнего вида промежности, раздражения, эритемы.
Животных, у которых обнаружены выраженные изменения или опухоли, не позволяющие повторить аппликацию, забивают, применяя гуманные методы, и исследуют ткани в соответствии с Г.3.7.1.
Через 24 ч после последнего введения исследуемого материала животных забивают с применением гуманных методов. Отсекают участок прямой и дистальную часть толстой кишки, разрезают вдоль и обследуют, отмечая наличие раздражения, повреждений эпителиального слоя или некроза тканей. Прямую и дистальную часть толстой кишки помещают в соответствующий фиксатор для дальнейших гистологических исследований.
Г.3.7 Оценка результатов
Г.3.7.1 Макроскопическое исследование
Сравнивают ткани прямой кишки подопытных и контрольных кроликов.
Регистрируют и описывают макроскопические изменения тканей прямой кишки каждого животного, отмечая различия между подопытными и контрольными участками.
Примечание - Эти наблюдения могут быть полезны для гистологических исследований.
Г.3.7.2 Гистологические исследования
Раздражающее действие на ткани прямой и толстой кишки проводят патоморфологи. Патоморфологи определяют состояние тканей в соответствии с системой классификации, представленной в таблице Г.2.
Баллы, полученные при микроскопическом исследовании всех животных подопытной группы, суммируют и делят на число наблюдений, чтобы определить средний балл в группе. Максимальное значение может достигать 16.
Те же вычисления повторяют для контрольной группы.
Общее число баллов большее девяти, полученное при микроскопическом исследовании у контрольных животных, свидетельствует о наличии травмы. Повторное исследование проводят, если другое исследование или другие контрольные животные дают такие же высокие баллы.
Разность средних баллов, полученных для подопытных и контрольных групп, дает индекс раздражения.
При оценке результатов длительного многократного воздействия таблицу Г.2 модифицируют, включив в нее дополнительные показатели реакции тканей, связанные с оценкой хронического раздражения.
Г.3.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
Г.4 Раздражающее действие на ткани влагалища
Г.4.1 Цель исследования
Оценка возможного раздражающего действия исследуемого материала на ткани влагалища.
Г.4.2 Исключение из исследования
Материалы, обладающие раздражающим действием на кожу и слизистую глаза, или рН которых меньше или равно 2 или больше или равно 11,5, исследованиям не подвергают и признают потенциальными раздражителями.
Г.4.3 Исследуемый материал
Твердые вещества (включая порошки) или жидкость готовят к исследованиям в соответствии с приложением А.
Если исследованиям подвергают вытяжку из образца, ее готовят в соответствии с приложением Б.
Г.4.4 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых самок кроликов-альбиносов весом не менее 2 кг. Использование животных других видов обосновывают.
Акклиматизацию и уход за животными осуществляют в соответствии с приложением В.
Для первичной оценки исследуемого материала в подопытную и контрольную группу берут по три особи.
При неудовлетворительных или сомнительных результатах, полученных при первичной оценке, проводят дополнительные исследования.
Животных перед экспериментом и перед каждым воздействием обследуют для выявления возможных повреждений влагалища: наличие опухолей, вагинальных инфекций, раздражения и т.д. Обследование проводят также для определения фазы овуляционного цикла, чтобы отличить реакцию тканей на возможное действие материала от физиологических изменений.
Г.4.5 Проведение исследований
Короткий (6 см) мягкий катетер или канюлю с тупым концом присоединяют к шприцу объемом 2 мл и более и заполняют шприц с катетером таким образом, чтобы количество исследуемого раствора не превышало 2 мл. Для каждого животного используют индивидуальный шприц с катетером.
Фиксируют животное с помощью удерживающего приспособления, которое обеспечивает свободный доступ к влагалищу, или с помощью лаборанта, осторожно удерживающего животное и фиксирующего его за задние конечности таким образом, чтобы открыть промежность.
Катетер перед введением смачивают контрольным раствором или специальной смазкой для облегчения ввода во влагалище.
Захватывают и поднимают хвост животного, открывая вход во влагалище. Мягко вводят катетер глубоко во влагалище и впрыскивают 2 мл исследуемой пробы из шприца, вынимают катетер.
Поскольку объем влагалища у животных неодинаков, исследуемый материал может частично выйти из влагалища во время или сразу после введения. Аккуратно удаляют остатки материала мягкой тканью.
Повторяют вышеописанную процедуру через 24 ч ежедневно в течение 5 сут.
В хроническом эксперименте число аппликаций, их продолжительность и интервалы между аппликациями зависят от особенностей применения изделия в медицинской практике.
Г.4.6 Обследование животных
Через 24 ч после первой аппликации и непосредственно перед следующей отмечают и регистрируют появление изменений внешнего вида входа во влагалище и промежности, эритемы, отека.
Животных, у которых обнаружены выраженные изменения или опухоли, не позволяющие повторить аппликацию, забивают, применяя гуманные методы, и исследуют ткани в соответствии с Г.4.7.1.
Через 24 ч после последнего введения исследуемого материала животных забивают с применением гуманных методов. Отделяют влагалище, разрезают вдоль и осматривают, отмечая наличие раздражения, повреждений эпителиального слоя и некроза тканей.
Влагалище помещают в фиксатор перед обработкой для гистологических исследований. Берут три кусочка из цервикальной, центральной и каудальной части влагалища.
Г.4.7 Оценка результатов
Г.4.7.1 Макроскопическое исследование
Сравнивают состояние влагалища подопытных и контрольных животных.
Регистрируют и описывают макроскопические изменения влагалища каждого животного, отмечая различия между подопытными и контрольными группами.
Примечание - Эти наблюдения могут быть полезны для гистологических исследований.
Г.4.7.2 Гистологические исследования
Раздражающее действие на ткани влагалища оценивают патоморфологи. Патоморфологи определяют состояние тканей в соответствии с системой классификации, представленной в таблице Г.2.
Баллы, полученные при микроскопическом исследовании всех животных подопытной группы, суммируют и делят на число наблюдений, чтобы определить средний балл в группе. Максимальное значение может достигать 16.
Те же вычисления повторяют для контрольной группы.
Общее число баллов большее девяти, полученное при микроскопическом исследовании у контрольных животных, свидетельствует о наличии травмы. Повторное исследование проводят, если другое исследование или другие контрольные животные дают такие же высокие баллы.
Разность средних баллов, полученных для подопытных и контрольных групп, дает индекс раздражения.
При оценке результатов длительного многократного воздействия таблицу Г.2 модифицируют, включив в нее дополнительные показатели реакции тканей, связанные с оценкой хронического раздражения.
Г.4.8 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
ПРИЛОЖЕНИЕ Д (справочное). Дополнительная информация
ПРИЛОЖЕНИЕ Д
(справочное)
Д.1 Дополнительная информация по изучению раздражающего действия
Раздражающее действие на кожу мелких лабораторных животных изучают с целью идентификации веществ, которые являются потенциальными раздражителями кожи и слизистых при применении в медицинской практике.
Первичными раздражителями являются вещества, которые при непосредственном воздействии вызывают воспалительные изменения кожи, характеризующиеся воспалением или в тяжелых случаях васкуляризацией и/или некрозом.
Драйз (Draize) исследовал кожное раздражающее действие, используя метод закрытых участков на кроликах-альбиносах. В соответствии с этим методом аппликацию исследуемых материалов проводят на выстриженные участки кожи спины при помощи пропитанных кусочков марли. Используют трех кроликов. Пропитанные веществом кусочки марли прикрепляют липкой лентой или пластырем и полупрозрачной повязкой на 4 ч. Через 4 ч повязку и кусочки марли снимают, участки кожи промывают и обследуют на наличие эритемы или отека. Реакцию оценивают через 24, 48 и 72 ч.
Регистром токсического действия химических веществ (RTECS) кролики признаны наиболее подходящим объектом для изучения раздражающего действия, так как позволяют получить достоверную и обширную информацию о кожных реакциях. 85% исследований из 2000, представленных RTECS, проведены на кроликах, 7,5% - на человеческом организме, 4% - на мышах, 3% - на морских свинках. Таким образом кроликов используют в преобладающем большинстве сообщений, опубликованных в открытой печати.
Сообщения об исследованиях на человеческом организме эфирных масел и других ароматических соединений, представленных исследовательским институтом душистых веществ, опубликованы в журнале "Пищевая и косметическая токсикология". Этот журнал также первый опубликовал данные об изучении раздражающего действия на мышах.
Mann и Pullinger в своем сообщении показывают, что экспериментальные исследования материалов на кроликах позволяют оценить их потенциальную опасность при применении в медицинской практике. Эти авторы доказывают преимущества изучения раздражающего действия на пигментированных глазах, а не на глазах, лишенных пигмента (альбино), и утверждают, что необходимо учитывать каждую индивидуальную реакцию при оценке раздражающего действия. Friedenwald и др. сообщают об использовании кроликов-альбиносов в качестве модели изучения раздражающего действия на глазах и приводят систему оценки в баллах, основанную на описании индивидуальных реакций каждого животного. Draize и др. модифицируют методику, предложенную Friedenwald, и предлагают свою систему оценки раздражающего действия на слизистой глаза. Этими авторами опубликован иллюстрированный указатель, предназначенный для оценки раздражающего действия на глаза.
Последние 20 лет исследователи предпринимают попытки найти и согласовать такой метод биологического исследования in vitro, который мог бы заменить острые опыты по изучению раздражающего действия на кожу и глаза. Последние десять лет национальные и международные организации успешно продвигаются в этом направлении. Несмотря на то что в последнее время было предложено большое количество методов исследования in vitro, ни один из них не обладает достаточной надежностью, и полученные при этом результаты недостоверны. Вследствие этого ни один из предложенных методов не был признан официально (Bruner et. al.). Параллельно поиску альтернативных методов исследования in vitro другие исследователи продолжают работу по усовершенствованию традиционных методов, что позволяет количественно оценить реакцию организма животных, лучше дифференцировать симптоматику, использовать неинвазивные методы (Nisson et. al., Emtestam.& Ollmar). После тщательного обзора литературы и консультаций с экспертами, использующими методы in vitro, было принято решение не включать указанные методы в настоящий стандарт до тех пор, пока работа не будет завершена и результаты не получат полного подтверждения.
Д.2 Дополнительная информация по изучению сенсибилизирующего действия
Сенсибилизация человеческого организма происходит в результате однократного или многократного эпикутанного воздействия и инициируется вовлеченными в процесс компонентами иммунной системы. Важно, что гаптен, нанесенный на кожу, обладает проникающей способностью. При соединении с белками кожи он превращается в антиген. Клетки Лангерганса из эпидермального и дермального слоев кожи вырабатывают на антиген специфические лимфоциты, которые запускают иммунный механизм. Незначительный процент этих лимфоцитов обладает долгосрочной памятью и является активатором во время провокационной фазы. Таким образом многократное воздействие может привести к ответным реакциям, которые сопровождаются движением лимфоцитов и других клеток, образующихся при воспалении, инициированных лимфоцитами с долгосрочной памятью, к участку повторной аппликации. В 1895 Jadassohn, используя метод исследования лоскутных аппликаций, исключил у пациента диагноз контактной аллергии на ртуть. Это новаторское исследование позволило подвести научную базу под методы диагностики, лечения и предупреждения контактной аллергии у человека и животных. Дальнейшее развитие методы исследования и предупреждения сенсибилизирующего действия материалов и изделий из них получили в работах Landsteiner и Chase, которые предложили использовать морских свинок для изучения гиперчувствительности замедленного типа. В 1965 Buehler предложил закрывать аппликационные участки для обеспечения максимального контакта и приближения условий эксперимента на животных к исследованиям на человеческом организме (повторение метода закрытых участков на человеческом организме HRIPT). Было доказано, что использование метода закрытых участков аппликации обеспечивает достаточную чувствительность и предотвращает средние и тяжелые случаи сенсибилизации, а также позволяет избежать экспериментальных исследований на человеческом организме при проведении HRIPT. Представленные результаты демонстрируют преимущества аппликаций перед внутрикожным введением и методом открытых участков аппликации. Стимуляцию иммунной системы различными адьювантами при этом не проводят. Этот метод официально признан достаточно чувствительным и относительно безопасным, позволяющим выявить даже слабые аллергены.
Magnusson и Kigman опробовали различные варианты исследований на морских свинках и предложили методику с использованием внутрикожного введения (с полным адьювантом Фрейнда или без него) и последующими накожными аппликациями исследуемого материала на тот же участок кожи. Предложена оригинальная методика, требующая предварительной обработки экспериментальных участков, если исследуемый материал не обладает раздражающим действием. Эта методика достаточно чувствительна и широко используется. Неординарный способ введения (внутрикожная инъекция) и использование полного адьюванта Фрейнда позволяет исключить основные компоненты иммунной системы (клетки Лангерганса), изменить структуру аллергена и вызвать экспериментальную толерантность.
Для оценки безопасности материалов наиболее часто используют два метода исследований: закрытых аппликаций в США и с адьювантом Фрейнда в Европе. Методическими руководствами ОЭСР и ЕЭС эти методы признаны предпочтительными. В настоящее время предложен ряд других методов, обладающих определенными преимуществами. Существует несколько современных технических приемов, позволяющих интенсифицировать процесс научных исследований. Экспериментаторы при этом используют унифицированную документацию. Во всех случаях использования других методов (таблица Д.1) в отчете об исследовании дают ссылку на литературный источник.
Таблица Д.1 - Альтернативные методы изучения сенсибилизирующего действия
1 Метод с использованием полного адьюванта Фрейнда |
2 Метод с использованием адьюванта Сплита |
3 Метод открытых эпикутанных аппликаций |
4 Оптимальный метод Мауера |
5 Пищевой метод (на морских свинках) |
6 Кумулятивный метод (с увеличением степени контакта) |
7 Скарификационный метод (с адьювантом и аппликациями) |
8 Метод исследования на ушах мыши |
9 Исследование регионарных лимфоузлов |
Пункт 9 в таблице Д.1 позволяет подсчитать увеличение (пролиферацию) лимфоцитов в лимфоузлах, регионарных к месту воздействия. На практике растворенный в органическом растворителе исследуемый материал несколько раз наносят на оба уха мышам с последующим внутривенным введением раствора метилтимидина в фосфатном буфере. Затем выделяют аурикулярные лимфоузлы, из одного лимфоузла готовят клеточную суспензию в трихлоруксусной кислоте, центрифугируют, обрабатывают сцинтиллирующей жидкостью [Н] с метилтримедином и подсчитывают количество бетта-сцинцилляций. Сравнивают с контролем, прошедшим такую же процедуру.
Исследовательский процесс не должен быть ориентирован только на одну экспериментальную модель, но его основная задача обеспечить максимальную безопасность потребителя. В качестве экспериментальной модели можно использовать животных и человеческий организм. У исследователей должна быть определенная степень свободы в выборе экспериментальной модели при наличии соответствующей узаконенной документации и научного обоснования.
В настоящее время Управление по охране окружающей среды США считает, что для регистрации и маркировки изделия или материала достаточно представить результаты исследований на восьми морских свинках. Рекомендуют проводить предварительные скрининговые исследования на морских свинках для новых материалов, а также веществ с высокой активностью, которая обусловлена их химической структурой. Выбор модели эксперимента на морских свинках зависит от имеющейся информации и опыта исследователя. Отрицательный ответ, полученный в экспериментах на морских свинках, может иметь определяющее значение при условии, что доза или концентрация исследуемого вещества в эксперименте значительно превышает указанные параметры при применении в медицинской практике. Не следует давать оценку исследуемого материала, базируясь только на одном примере резко выраженного действия. В каждом конкретном случае всегда учитывают практическое использование материалов и изделий.
ПРИЛОЖЕНИЕ Е (справочное). Изучение сенсибилизирующего действия на белых крысах
ПРИЛОЖЕНИЕ Е
(справочное)
Е.1 Цель исследования
Оценка возможного сенсибилизирующего действия материала на белых крысах с использованием иммунологических методов, основанных на определении образования комплекса антиген-антитело.
Е.2 Исследуемый материал
Вытяжку из образца готовят в соответствии с приложением Б.
Е.3 Экспериментальные животные и их содержание
Используют здоровых молодых половозрелых белых крыс одной линии обоего пола с исходной массой 200-250 г. В эксперименте не используют беременных самок или животных после спаривания.
Акклиматизацию и содержание животных осуществляют в соответствии с приложением В.
Используют не менее 10 животных на каждую вытяжку из материала или изделия, контрольную группу составляют не менее 5 крыс.
Е.4 Проведения исследования
Е.4.1 Подготовка
Шерсть на участках кожи, где предполагают производить инъекции и аппликации, тщательно выстригают за 4-24 ч до начала эксперимента.
Е.4.2 Внутрикожная предварительная сенсибилизация
В наружную поверхность уха или в выстриженный бок подопытных животных внутрикожно вводят 0,02 мл вытяжки из изделия или материала. Контрольным животным вводят 0,02 мл модельной среды. Наблюдение за состоянием кожи проводят через 15 мин, 1, 24, 48 и 72 ч после введения. При наличии явлений раздражения исследование прекращают.
Е.4.2 Фаза местного воздействия
Через 10 сут проводят 5-7 накожных аппликаций по 0,5 мл вытяжки на выстриженные заранее участки кожи бока размером 1x1 см, слегка втирая ее стеклянным шпателем. Контрольным животным проводят аппликации модельной среды в том же режиме. Ежедневно отмечают наличие или отсутствие видимой реакции раздражения и оценивают реакцию в соответствии с таблицами E.1 и Е.2.
Таблица E.1 - Оценка кожно-раздражающего действия
Кожная реакция | Оценка в баллах |
Эритема | |
Нет эритемы | 0 |
Очень слабая эритема | 1 |
Отчетливая эритема | 2 |
Средняя эритема | 3 |
Сильная эритема | 4 |
Образование отека | |
Нет отека | 0 |
Очень слабый отек | 1 |
Отчетливый отек | 2 |
Средний отек (возвышение на 1 мм) | 3 |
Сильный отек (возвышение более 1 мм) | 4 |
Общий возможный балл, оценивающий раздражение, - 8 | |
Таблица Е.2 - Оценка кожно-раздражающего действия
Кожная реакция | Средний балл |
Не принимается во внимание | 0-0,4 |
Слабая реакция | 0,5-1,9 |
Средняя реакция | 2-4,9 |
Сильная реакция | 5-8 |
Е.4.3 Провокационная проба
Через сутки после последней аппликации проводят провокационную внутрикожную пробу. Для этого 0,02 мл свежеприготовленной вытяжки вводят внутрикожно в противоположный аппликациям бок каждого животного. Реакцию на провокационную пробу отмечают через 15 мин, 24 и 48 ч.
Е.4.4 Специфические иммунологические методы
Через 48 ч после проведения внутрикожной пробы животных забивают декапитацией, отбирая кровь для проведения специфических иммунологических реакций. Используют иммунологические методы, основанные на определении образования комплекса антиген-антитело: реакцию дегрануляции тучных клеток (РДТК), реакцию пассивной гемагглютинации (РПГА), реакцию связывания комплемента (РСК), реакцию специфической агломерации лейкоцитов (РСАЛ), реакцию специфического лизиса лейкоцитов (РССЛ).
До начала проведения иммунологических специфических реакций тщательно подбирают рабочую концентрацию вытяжки, не вызывающую денатурации сывороточных белков и не оказывающую цитотоксического действия.
У забитых животных определяют коэффициенты массы иммунокомпетентных органов - селезенки и тимуса и обрабатывают полученный материал статистически с определением коэффициента Стьюдента "t".
Е.4.5 Оценка результатов
При оценке сенсибилизирующего действия учитывают результаты предварительной внутрикожной сенсибилизации, реакции кожи на аппликационное воздействие, провокационной пробы в соответствии с таблицами E.1 и Е.2, определения коэффициентов массы иммунокомпетентных органов и иммунологических реакций с кровью животных.
Е.4.6 Представление результатов
В отчет об исследовании включают:
- описание исследуемого образца;
- предполагаемый способ применения материала или изделия;
- подробное описание подготовки образца к исследованиям;
- вид экспериментальных животных;
- способ аппликации исследуемых образцов;
- методы ведения наблюдений и их регистрации;
- оценку результатов.
ПРИЛОЖЕНИЕ Ж (справочное). Библиография
ПРИЛОЖЕНИЕ Ж
(справочное)
Общая ссылка на исследования раздражающего действия на кожу и глаза, а также сенсибилизирующего действия на кожу
[I] Marzulli, F.N. and Maibach, H.I. (eds.) Dermatoxicology, 3 ed, Hemisphere Publishing Corporation, 1987
Библиография по исследованию раздражающего действия на кожу и глаза
[2] Bruner, L.H., Kain, D.J., Roberts, D.A. and Parker, R.D. Evaluation of Seven in vitro Alternatives for Ocular Testing. Fund. and App. Toxicol. 17, pp. 136-149, 1991
[3] Consumer Product Safety Act. 15 U.S. Congress 2041, 1972
[4] Draize, J.H. Dermal Toxicity. Association of Food and Drug Officials of the U.S., pp. 46-59, 1955, FDA. Washington, D.C
[5] Draize, J.H. Appraisal of the Safety of Chemicals in Foods, Drugs, and Cosmetics, 1959, Austin, Texas, Association of Food and Drug Officials of the United States, Texas State Department of Health, Texas
[6] Emtestam, L. and Ollmar, S. Electrical Impedance Index in Human Skin: Measurements after Occlusion, in 5 Anatomical Regions and in Mild Contact Dermatitis. Contact Dermatitis, 28, p. 104, 1993
[7] European Chemical Industry Ecology and Toxicology Centre. Eye Irritation Testing, Monograph 11, 1988, Brussels, Belgium
[8] European Chemical Industry Ecology and Toxicology Centre. Skin Irritation, Monograph 15, 1990, Brussels, Belgium
[9] Grant, M.W. Toxicology of the Eye, 3 ed, Springfield, III., 1986
[10] Mac Millan, F.S., Rafft, R.R. and Cloers, W.B. A Comparison of the Skin Irritation Produced by Cosmetic Ingredients and Formulations in the Rabbit, Guinea Pig, and Beagle Dog to that observed in the Human. Animal Models in Dermatology, Maibach, H.I. (ed.), N.Y., Churchill Livingstone, pp. 12-22, 1975
[11] National Academy of Sciences. Principles and Procedures for Evaluating the Toxicity of Household Substances, Washington, D.C. Comparisons of Skin Irritancy. Toxicol. Appl. Pharmacol. 31, pp. 481-90, 1977
[12] National Academy of Sciences - National Research Council.In: Principles of Evaluating Chemicals in the Environment. NAS Publication for the Environmental Protection Agency: Eye Irritation, pp. 104-105, 1975
[13] Organization for Economic Cooperation and Development (OECD), Guidelines for Testing of Chemicals No. 404, Acute Skin Irritation/Corrosion and No. 405 Acute Eye Irritation/Corrosion. OECD Publications
[14] Pesticide Assessment Guidelines, Subdivision F, Hazard Evaluation Human and Domestic Animals. 81-4 Eye Irritation and 81-5 Dermal Irritation. Office of Pesticide Programs, U.S. Environmental Protection Agency
[15] Prince, J.H., Diesem, C.D., Eglitis, I. and Ruskell, G.L. Anatomy and Histology of the Eye and Orbit in Domestic Animals. Springfield, III., 1980
[16] Steinberg, M., Akers, W.A., Weeks, M., McCreesh, A.H. and Maibach, H.I. Comparison of Test Techniques Based on Rabbit and Human Skin Responses to Irritants with Recommendations, Regarding the Evaluation of Mildly or Moderately Irritating Compounds. Animal Modes in Dermatology. Maibach H.I. (ed. 0, N.Y., Churchill Livingstone, pp. 1-11, 1975)
[17] Weil, S.C. and Scala, R.A. Study of Intra-Interlaboratory Variability in the Results of Rabbit Eye and Skin Irritation Tests. Toxicol. Appl. Pharmacl. 12, pp. 276-360, 1971
[18] Wolven, A. and Levenstein, I. Techniques for Evaluating Dermal Irritation. J. Soc. Cos. Chem. 18, pp. 199-203, 1967
Библиография по исследованию раздражающего действия на слизистую оболочку полости рта
[19] Nilsson, R., Fallan, J.O., Larsson, K.S., Ollmar, S. and Sundstrom, F. Electical Impedance - A New Parameter for Oral Mucosal Irritation Tests. J. Mater. Science: Materials in Medicine, 3, p. 278, 1992
[20] Pilicro, S.J. et al. Biocompatibility Evaluation of Casting Alloys in Hamsters. J. Prosthet. Dentistry, 41, pp. 221-223, 1979
[21] Roy, M. and White, H.I. Establishment of an Improved Technique for Hamster Mucous Membrane Irritation. Testing. J. Dent. Res., 11, pp. 1365-1375, 1986
Библиография по исследованию раздражающего действия на влагалище
[22] Chvapil, M., Chvapil, T.A., Owen, J.A., Kantor, M., Ulreich, J.B. and Eskelson, C. Reaction of Vaginal Tissue of Rabbits to Inserted Sponges Made of Various Materials. J. Biomed. Mater. Res., 13:1, 1979
[23] Draize, J.H. Dermal Toxicity. Appraisal of the Safety of Chemicals in Foods, Drugs and Cosmetics, Association of Food and Drug Officials of the United States, Texas State Department of Health, Texas, 1959
[24] Ekstein, P., Jackson, H.C.N., Millman, N. and Sabrero, A.J. Comparisons of Vaginal Tolerance Tests of Spermicidal Preparations in Rabbits and Monkeys. J. Reprod, and Fert., 20:85, 1969
[25] Kaminsky, M. and Willigan, D.A. pH and the Potential Irritancy of Douche Formulations to the Vaginal Mucosa of the Albino Rabbit and Rat. Fd. Chem. Toxicol., 20:193, 1982
[26] Muller, P., Paabe, G., Horold, J. and Juretzek, U. Action of chronic peracetic acid (wofasteril) administration on the rabbit oral mucosa, vaginal mucosa and skin. Exp. Pathology, 34:223, 1988
Библиография по исследованию раздражающего действия на кожу
[27] Anderson, K.E. and Maibach, H.I. Contact Allergy Predictive Tests in Guinea Pigs. S. Karger, New York, 1985
[28] Buehler, E.V. Delayed Contact Hypersensitivity in the Guinea Pig. Arch. Dermatol., 91, pp. 171-175, 1965
[29] European Chemical Industry Ecology and Toxicology Centre. Skin Sensitization Testing, Monograph 14, 1990, Brussels, Belgium
[30] Kimber, I. and Basketter, D.A. The Murine Local Lymph Node Assay: A Commentary on Collaborative Studies and New Directions. Fd. Chem. Toxicol., 30, pp. 165-169, 1992
[31] Landsteiner, К. and Chase, M.W. Studies on the Sensitization of Animals with Simple Chemical Compounds. J. Exp. Med., 69:767, 1939
[32] Magnusson, В. and Kligman, A.M. The Identification of Cntact Allergens by Animal Assay. The Guinea Pig Maximization Test. J. Invest. Dermatol., 52, pp. 268-276, 1969
[33] Newman, E.A., Buehler, E.V. and Parke5, R.D. Delayed Contact Hypersensitivity in the Vagina and Skin of the Guinea Pig. Immunology, 63:119, 1983
[34] Nordiske Seminar-og Arbejds-rapporter. Potency Evaluation of Contact Allergens-Dose response studies using the Guinea Pig Maximization test, 1993
[35] Organization for Economic Cooperation and Development (OECD) Guidelines for the Testing of Chemicals No. 406 Skin Sensitization, OECD Publications
[36] Ritz, H.L. and Buehler, E.V. Current concepts in Cutaneous Toxicity, Drill, V. and Lazar, P. (eds.) Academic Press, New York, pp. 25-40
[37] Roberts, D.W. Contact Dermatitis, 17, pp. 281-289, 1987
[38] Robinson, M.K., Stotts, J., Danneman, P.J., Nusair, T.L. and Bay, P.H.S. A Risk Assessment Process for Allergic Contact Sensitization. Fd. Chem. Toxicol., 27, pp. 479-489, 1989
[39] Robinson, M.K., Nusair, T.L., Eletcher, E.R. and Ritz, H.L. A review of the Buehler Guinea Pig Skin Sensitization Test and its use in a Risk Assessment Process for Human Skin Sensitization. Toxicology. 61, pp. 91-107, 1990
[40] ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
[41] ГОСТ Р 50855-96 Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний