ГОСТ Р ИСО 10993.1-99
Группа Р20
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 1
Оценка и исследования
Medical devices. Biological evaluation of medical devices.
Part 1. Evaluation and testing
ОКС 01.140.20*
ОКСТУ 9403
________________
* В указателе "Национальные стандарты" 2007 г. ОКС 11.040. -
Примечание изготовителя базы данных.
Дата введения 2002-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 862-ст
3 Разделы (приложения) настоящего стандарта, за исключением приложения В, представляют собой аутентичный текст ИСО 10993-1-97 (второе издание) "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ГОСТ Р ИСО 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В серию ГОСТ Р ИСО 10993 входят следующие стандарты в области биологического действия медицинских изделий:
ГОСТ Р ИСО 10993.1 - оценка и исследования;
ГОСТ Р ИСО 10993.3 - исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
ГОСТ Р ИСО 10993.4 - исследование изделий, взаимодействующих с кровью;
ГОСТ Р ИСО 10993.5 - исследование на цитотоксичность: методы in vitro;
ГОСТ Р ИСО 10993.6 - исследование местного действия после имплантации;
ГОСТ Р ИСО 10993.7 - остаточное содержание этиленоксида после стерилизации;
ГОСТ Р ИСО 10993.9 - основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
ГОСТ Р ИСО 10993.10 - исследование раздражающего и сенсибилизирующего действия;
ГОСТ Р ИСО 10993.11 - исследование общетоксического действия;
ГОСТ Р ИСО 10993.12 - приготовление проб и стандартные образцы;
ГОСТ Р ИСО 10993.13 - идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
ГОСТ Р ИСО 10993.16 - моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
Настоящий стандарт является основополагающим в серии стандартов ГОСТ Р ИСО 10993, а также руководящим документом по выбору методов оценки биологического действия в соответствии с требованиями безопасности применения медицинских изделий и материалов.
Кроме того, назначение настоящего стандарта - ограничить рамки биологических исследований таким образом, чтобы снизить до минимума количество экспериментальных животных и их подверженность вредному воздействию.
Приложение А содержит пояснения к основной части стандарта.
Приложение Б содержит схему системного подхода к оценке биологического действия медицинских изделий.
Приложение В содержит ряд документов по стандартизации, которыми руководствуются при оценке биологического действия медицинских изделий.
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 9001-96 Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании*
__________________
* На территории Российской Федерации действует ГОСТ Р ИСО 9001-2001, здесь и далее по тексту. - Примечание изготовителя базы данных.
ГОСТ Р ИСО 10993.3-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
ГОСТ Р ИСО 10993.4-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий, взаимодействующих с кровью
ГОСТ Р ИСО 10993.5-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro
ГОСТ Р ИСО 10993.6-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации
ГОСТ Р ИСО 10993.9-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции
ГОСТ Р ИСО 10993.10-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия
ГОСТ Р ИСО 10993.11-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия
ИСО 9004-1-94* Руководство по управлению качеством и элементы системы качества. Основные положения
________________
* Международные стандарты находятся во ВНИИКИ Госстандарта России.
1 Область применения
Настоящий стандарт устанавливает следующие положения:
- основные принципы оценки биологического действия медицинских изделий;
- определение категории медицинского изделия на основе характера и продолжительности контакта с организмом человека;
- выбор соответствующих методов исследований.
Положения стандарта не распространяются на материалы и медицинские изделия, которые не имеют контакта с телом пациента ни непосредственно, ни опосредованно. Стандарт также не устанавливает требования, направленные на предотвращение опасности для пациента, которая может возникнуть в результате каких-либо отказов медицинских изделий (механических, электрических или др.).
Требования настоящего стандарта являются рекомендуемыми.
2 Определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
2.1 медицинское изделие: Любой прибор, аппарат, приспособление, материал или другое изделие, включая программное обеспечение, используемое либо изолированно, либо в комбинации, которое предназначено изготовителем для применения, главным образом, в следующих целях:
- диагностика, профилактика, наблюдение, лечение или облегчение болезни;
- компенсация повреждения органов или физического недостатка;
- исследование, замена или изменение анатомии или физиологического процесса;
- контрацепция -
и которое не является фармакологическим, иммунологическим или метаболическим средством, но может быть дополнено такими средствами.
Примечание - Термин "медицинское изделие" включает в себя изделия стоматологического назначения.
2.2 материал: Любой синтетический или природный полимер, металл, сплав, керамика или другой материал, включая биологическую ткань, используемый в качестве медицинского изделия или его части.
2.3 конечный продукт: Медицинское изделие в том состоянии, в котором его применяют в медицинской практике.
3 Основные принципы оценки биологического действия материалов и медицинских изделий
3.1 Выбор любого материала или медицинского изделия (далее - изделие), предназначенного для применения в медицинской практике, или материала, предназначенного для изготовления изделия, осуществляют на основе системного подхода к оценке биологического действия.
Планирование разработки изделия осуществляют на основе информации, полученной в том числе из нормативных документов и научной литературы, с учетом преимуществ и недостатков различных пригодных материалов и методов исследования.
В целях обеспечения гарантии того, что изделие в готовом виде будет функционировать в соответствии с назначением и его применение будет безопасно для человека, в плане разработки изделия предусматривают этапы оценки биологического действия материалов, предназначенных для изготовления изделия, а также готового изделия.
Программу оценки биологического действия изделия разрабатывают и документально оформляют специалисты, способные принимать решения на основе информации о преимуществах и недостатках различных материалов и методов исследований.
3.2 Материалы, предназначенные для изготовления изделия, должны соответствовать назначению изделия по их химическим, физическим, электрическим, механическим, токсикологическим, морфологическим и другим свойствам.
3.3 При оценке соответствия материала назначению изделия рассматривают следующее:
- свойства и характеристики конечного продукта;
- источник поступления - изготовитель материала (материалов);
- добавки, примеси и остаточные вещества в результате обработки;
- продукты вымывания;
- продукты деструкции;
- прочие компоненты и их взаимодействие в конечном продукте.
Примечание - При необходимости оценке биологического действия могут предшествовать идентификация и количественное определение входящих в конечный продукт экстрагируемых химических компонентов в соответствии с ГОСТ Р ИСО 10993.9.
3.4 При проведении исследований и интерпретации результатов оценки биологического действия учитывают состав материалов, условия воздействия, вид, частоту и продолжительность контакта изделия или его частей с организмом человека. В соответствии с указанными факторами медицинские изделия подразделяют на категории.
Изделия относят к определенной категории в соответствии с положениями раздела 4.
При контакте изделия с организмом человека диапазон возможного биологического риска может включать в себя:
- кратковременный эффект (например, острая токсичность, раздражение кожи, глаз и слизистых оболочек, повышение чувствительности, гемолиз, тромбообразование);
- отдаленный или специфический токсический эффект (например, субхронический или хронический эффект, повышение чувствительности, генотоксичность, канцерогенность и воздействие на репродуктивную функцию, включая тератогенность).
3.5 Для каждого материала и конечного продукта анализируют все виды биологического риска. Это не означает, что экспериментальные исследования риска всех видов необходимы или выполнимы (см. раздел 5).
3.6 Исследования in vitro или in vivo проводят с учетом условий применения конечного продукта, уровня владения лабораторной практикой, последующей интерпретации результатов исследований специалистами соответствующего направления.
При возможности исследования in vitro проводят до начала исследований in vivo.
Данные исследований, которые позволяют сделать независимое заключение о соответствии материала или конечного продукта назначению, сохраняют.
3.7 Повторную биологическую оценку материалов или конечных продуктов проводят при любых изменениях:
- источника поступления или любой характеристики материалов, идущих на производство изделия;
- состава, первичной упаковки или метода стерилизации конечного продукта;
- свойств конечного продукта при хранении;
- предполагаемого изменения применения изделия, -
а также при наличии любого признака, что изделие во время применения может нежелательно воздействовать на человека.
3.8 При оценке биологического действия изделия учитывают результаты биологических исследований, проведенных в соответствии с положениями настоящего стандарта, природу и мобильность ингредиентов материалов, используемых для изготовления изделия, а также другую информацию, в том числе результаты доклинических и клинических исследований и данные об изделии после выпуска из производства (см. А.2, пояснение 3.8).
4 Классификация медицинских изделий
На основании принципов, изложенных в разделе 3, изделия подразделяют на категории. Отнесение изделия к определенной категории облегчает выбор методов исследования.
Программу исследований изделия, не входящего ни в одну категорию, разрабатывают в соответствии с положениями настоящего стандарта. В том случае, когда изделие может быть отнесено более чем к одной категории, устанавливают необходимость проведения исследований в соответствии с требованиями к каждой категории.
4.1 Классификация изделий в соответствии с видом контакта с организмом человека
Изделия подразделяют на категории в соответствии с видом контакта с организмом человека (далее - контакт).
4.1.1 Неконтактирующие изделия
Настоящий стандарт не распространяется на изделия, не имеющие ни непосредственного, ни опосредованного контакта с организмом человека.
4.1.2 Изделия, контактирующие с поверхностью тела человека
В данную группу входят изделия, контактирующие со следующими поверхностями:
- с кожей. К данной категории относят изделия, контактирующие с неповрежденной кожей, например электроды, внешние протезы, фиксирующие ленты, компрессионные повязки и мониторы различных типов;
- со слизистыми оболочками. К данной категории относят изделия, контактирующие с неповрежденными слизистыми оболочками, например контактные линзы, мочевыводящие катетеры, внутривагинальные и внутрикишечные изделия (желудочные зонды, сигмоидоскопы, колоноскопы, гастроскопы), эндотрахеальные зонды, бронхоскопы, зубные протезы, изделия для ортодонтии и внутриматочные изделия;
- с поврежденными или подверженными опасности повреждений поверхностями. К данной категории относят изделия, контактирующие с поврежденными или подверженными опасности повреждения поверхностями тела, например повязки или лечебные средства и герметичные повязки на язвы, ожоги, грануляционную ткань.
4.1.3 Изделия, присоединяемые извне
К данной категории относят изделия, контактирующие со следующими участками организма человека:
- с системой кровообращения. Изделия, контактирующие с системой кровообращения в одной точке и служащие для входа в кровеносную систему, например устройства для введения растворов, переливания крови;
- с мягкими тканями, костными тканями, дентином. Изделия и материалы, контактирующие с мягкими тканями, костью и системой канал - дентин, например лапароскопы, артроскопы, системы дренирования, цемент для стоматологии, пломбировочные материалы и кожные скобки;
- с циркулирующей кровью. Изделия, контактирующие с системой кровообращения, например временные электроды кардиостимулятора, оксигенаторы и принадлежности к ним, диализаторы, трубки и принадлежности для диализа, гемо- и иммуносорбенты.
4.1.4 Имплантируемые изделия
К данной категории относят изделия, контактирующие со следующими участками организма человека:
а) с внутренними тканями организма:
1) изделия, контактирующие с костью, например ортопедические шпильки, пластинки, искусственные связки, костные цементы, внутрикостные приспособления,
2) изделия, контактирующие с мягкими тканями и межтканевой жидкостью, например кардиостимуляторы, изделия для введения лекарственных средств, нервно-мышечные датчики и стимуляторы, искусственные сухожилия, имплантаты грудной железы, протезы гортани (искусственная гортань), имплантаты надкостницы и клипсы для кровеносных сосудов;
б) с кровью. Изделия, контактирующие с кровью, например электроды кардиостимулятора, искусственные артерио- и венозные фистулы, сердечные клапаны, трансплантаты сосудов, катетеры для введения лекарств в кровеносное русло, стимуляторы желудочка сердца.
4.2 Классификация изделий в зависимости от продолжительности контакта
Изделия подразделяют на категории в зависимости от продолжительности контакта следующим образом:
- кратковременного контакта А. Изделия однократного, многократного или непрерывного использования, контакт которых в общей сложности составляет менее 24 ч;
- длительного контакта Б. Изделия однократного, многократного или непрерывного использования, контакт которых превышает 24 ч, но составляет не более 30 сут;
- постоянного контакта В. Изделия однократного, многократного или непрерывного использования, контакт которых превышает 30 сут.
Если по продолжительности контакта материал или изделие могут быть отнесены более чем к одной категории, то исследования проводят по программе, соответствующей наибольшей продолжительности контакта.
При отнесении изделия многократного применения к определенной категории по продолжительности контакта учитывают потенциальный кумулятивный эффект, суммируя время, в течение которого протекает контакт.
5 Исследования
5.1 Основные положения
Кроме основных принципов, изложенных в разделе 3, при оценке биологического действия изделий руководствуются следующим:
а) исследованиям подвергают конечный продукт или репрезентативные образцы конечного продукта или материалов;
б) при выборе методов исследований учитывают:
1) вид, степень, продолжительность, частоту и условия воздействия изделия на организм человека или контакта с ним при использовании по назначению,
2) химическую и физическую природу конечного продукта,
3) потенциальную токсичность химических веществ, использованных при изготовлении конечного продукта,
4) возможность исключения некоторых тестов, когда характер вымываемых веществ известен и уровень их токсичности допустим (например, предназначенные для оценки общетоксического действия),
5) отношение поверхности изделия или его частей, контактирующих с организмом человека, к размерам тела реципиента,
6) информацию из литературных источников, а также опыт и результаты доклинических исследований,
7) основную цель - охрану здоровья человека, а также обеспечение хороших условий содержания подопытных животных, сведение до минимума количества используемых подопытных животных и вредного воздействия на них;
в) модельную среду и условия экстракции для получения вытяжки из изделий выбирают в соответствии с природой и назначением конечного продукта;
г) при необходимости используют положительный и отрицательный контроль;
д) поскольку положительные результаты исследований не гарантируют отсутствия биологического риска, исследования сопровождают наблюдением за неожиданными нежелательными реакциями или явлениями у человека во время применения изделия по назначению.
Библиографический перечень международных стандартов и руководств по исследованию потенциальных биологических реакций приведен в приложении В.
5.2 Общие методы оценки биологического действия медицинских изделий
Общие методы исследований выбирают в соответствии с 5.2.1-5.2.9.
5.2.1 Цитотоксическое действие
Лизис клеток, замедление роста клеток, а также воздействия других видов на клетки, обусловленные контактом с изделиями, материалами и (или) вытяжками из них, определяют с помощью методов исследования с использованием клеточных культур.
Методы исследования цитотоксического действия выбирают в соответствии с ГОСТ Р ИСО 10993.5.
5.2.2 Сенсибилизирующее действие
Сенсибилизирующее действие, обусловленное контактом с изделиями, материалами и (или) вытяжками из них, оценивают, используя соответствующую модель. Исследование сенсибилизирующего действия необходимо, так как контакт с потенциальными мигрирующими веществами или их воздействие даже в течение нескольких минут может вызвать аллергическую реакцию.
Методы исследования сенсибилизирующего действия выбирают в соответствии с ГОСТ Р ИСО 10993.10.
5.2.3 Раздражающее действие
Раздражающую способность изделий, материалов и (или) вытяжек из них оценивают, используя определенные участки тела подопытного животного (кожа, глаза или слизистая оболочка). При выборе конкретного метода определения раздражающего действия учитывают вид контакта (кожа, глаза, слизистая оболочка) и продолжительность контакта или воздействия.
Методы исследования раздражающего действия выбирают в соответствии с ГОСТ Р ИСО 10993.10.
5.2.4 Внутрикожная реакция
Местную реакцию ткани на вытяжки из изделий оценивают с помощью метода внутрикожной пробы. Этот метод применяют в случаях, когда определение раздражающего действия на коже и слизистой оболочке непригодно (например, при исследовании изделий, контактирующих с кровотоком), предпочтительно в случаях, когда экстрагируемые вещества гидрофобны.
5.2.5 Общетоксическое действие
Вредный эффект, обусловленный изделиями, материалами и (или) вытяжками из них, при однократном или многократном воздействии на подопытных животных в течение менее 24 ч оценивают с помощью методов исследования общетоксического действия. Эти методы применяют в случаях, когда при контакте возможна абсорбция токсичных мигрирующих агентов и продуктов деструкции.
Тесты на пирогенность используют для определения пирогенных реакций экстрактов из изделий или материалов. При этом имеют в виду, что с помощью одного теста невозможно определить, вызвана ли пирогенность самой вытяжкой или загрязнением эндотоксином.
Методы исследования общетоксического действия выбирают в соответствии с ГОСТ Р ИСО 10993.11.
5.2.6 Субхроническая (подострая) токсичность
С помощью методов исследования субхронической токсичности определяют эффект однократного или многократного контакта с изделием, материалами и (или) вытяжками из них или воздействия в течение не менее 24 ч, но не более 10% жизненного цикла подопытного животного (например до 90 сут у крыс).
Исследования субхронической токсичности можно не проводить для материалов, о которых имеются данные о хронической токсичности. В отчете о результатах исследований указывают причину, из-за которой исследования субхронической токсичности не проводили.
Методы исследования субхронической токсичности выбирают в соответствии с видом и продолжительностью контакта.
5.2.7 Генотоксичность
При исследовании генотоксичности используют клеточные культуры млекопитающих и других животных. Допустимы и другие методы исследования генных мутаций, изменений структуры и числа хромосом, а также других токсических воздействий на дезоксирибонуклеиновую кислоту (ДНК) или гены, обусловленных контактом с изделием, материалами и (или) вытяжками из них.
Методы исследования генотоксичности выбирают в соответствии с ГОСТ Р ИСО 10993.3.
5.2.8 Имплантация
С помощью имплантационного теста оценивают местное патогенное действие на живую ткань (на макроскопическом и микроскопическом уровнях) при изучении образца материала или конечного продукта. Образец материала или конечного продукта имплантируют хирургическим путем в определенную ткань подопытного животного в соответствии с предполагаемым применением (например, исследование стоматологических материалов).
Выбранные методы исследований обычно соответствуют виду и продолжительности контакта. При изучении материалов, если одновременно определяют общее токсическое действие, выбирают методы исследований, эквивалентные исследованию субхронической токсичности.
Методы исследования местного действия после имплантации выбирают в соответствии с ГОСТ Р ИСО 10993.6.
5.2.9 Гемосовместимость
При исследованиях гемосовместимости оценивают воздействие на кровь или ее компоненты при контакте изделий, материалов с соответствующей моделью или системой.
Тесты на гемосовместимость разрабатывают так, чтобы были смоделированы геометрия, условия контакта и динамика кровотока внутри изделия или материала во время клинического применения.
Исследование гемолиза позволяет определить степень лизиса эритроцитов и высвобождение гемоглобина под воздействием изделий, материалов и (или) вытяжек из них in vitro.
Методы исследования гемосовместимости выбирают в соответствии с ГОСТ Р ИСО 10993.4.
5.3 Дополнительные методы исследований
Дополнительные методы исследований выбирают в соответствии с 5.3.1-5.3.4.
5.3.1 Хроническая токсичность
При исследованиях хронической токсичности оценивают эффект однократного или многократного действия изделий, материалов и (или) вытяжек из них в течение периода времени, составляющего не менее 10% продолжительности жизни лабораторного животного (например до 90 сут у крыс).
Методы исследований хронической токсичности выбирают по ГОСТ Р ИСО 10993.3 в соответствии с видом и продолжительностью контакта или воздействия.
5.3.2 Канцерогенность
При исследованиях канцерогенности изучают указанную активность изделий, материалов и (или) вытяжек из них в результате однократного, многократного контакта или воздействия в течение периода времени, составляющего большую часть жизненного цикла животного. Эти исследования позволяют одновременно изучить хроническую токсичность и канцерогенность в рамках одного эксперимента.
Исследования канцерогенности проводят в тех случаях, когда имеют данные из других источников, предполагающие подобную активность.
Методы исследования канцерогенности выбирают по ГОСТ Р ИСО 10993.3 в соответствии с видом и продолжительностью контакта или воздействия.
5.3.3 Токсическое воздействие на репродуктивную функцию и развитие
При этих исследованиях оценивают способность материалов, изделий и (или) вытяжек из них оказывать вредное воздействие на репродуктивную функцию, развитие эмбриона (тератогенность), на пренатальное (внутриутробное) и постнатальное развитие.
Указанные исследования проводят в тех случаях, когда имеют данные из других источников о том, что изделие может обладать способностью воздействовать на репродуктивную функцию и развитие субъекта. При этом учитывают вид и продолжительность контакта.
Методы исследования токсического действия на репродуктивную функцию и развитие выбирают в соответствии с ГОСТ Р ИСО 10993.3.
5.3.4 Биодеградация
При наличии способности изделий или материалов к рассасыванию или деструкции используют специальные методы исследований. Исследования процессов абсорбции, распространения, биотрансформации и выведения продуктов деструкции изделий, материалов и (или) вытяжек из них проводят в соответствии с ГОСТ Р ИСО 10993.9.
6 Выбор методов оценки биологического действия
Оценить биологическое действие изделий и материалов можно как изучением соответствующего предыдущего опыта, так и проведением экспериментальных исследований.
При наличии данных об использовании изделия и (или) материала в качестве, аналогичном тому, в котором он будет применен, может быть дано заключение об отсутствии необходимости в проведении экспериментального исследования изделия и (или) материала.
В таблице 1 указаны методы, рекомендуемые для общей оценки изделий и (или) материалов в зависимости от категории изделия.
Таблица 1 - Рекомендуемые методы общей оценки биологического действия медицинских изделий
Категория изделий в зависимости от контакта с организмом человека | Метод исследований | |||||||||
Группа изделий | Вид контакта | Продолжи- тельность контакта | Цито- | Сенси- | Раз- | Об- | Суб- | Гено- | Имплан- | Гемо- |
Изделия поверх- | Кожа | А | + | + | + | - | - | - | - | - |
Б | + | + | + | - | - | - | - | - | ||
В | + | + | + | - | - | - | - | - | ||
Слизистая оболочка | А | + | + | + | - | - | - | - | - | |
Б | + | + | + | - | - | - | - | - | ||
В | + | + | + | - | + | + | - | - | ||
Поврежденные или подверженные опасности повреждения поверхности | А | + | + | + | - | - | - | - | - | |
Б | + | + | + | - | - | - | - | - | ||
В | + | + | + | - | + | + | - | - | ||
Изделия, присое- | Непрямой кровоток | А | + | + | + | + | - | - | - | - |
Б | + | + | + | + | - | - | - | + | ||
В | + | + | - | + | + | + | - | + | ||
Мягкие ткани, кость, дентин | А | + | + | + | - | - | - | + | - | |
Б | + | + | - | - | - | + | + | - | ||
В | + | + | - | - | - | + | + | - | ||
Система крово- | А | + | + | + | + | - | - | - | + | |
Б | + | + | + | + | - | + | - | + | ||
В | + | + | + | + | + | + | - | + | ||
Имплан- | Мягкая ткань, кость | А | + | + | + | - | - | - | - | - |
Б | + | + | - | - | - | + | + | - | ||
В | + | + | - | - | - | + | + | - | ||
Кровь | А | + | + | + | + | - | - | + | + | |
Б | + | + | + | + | - | + | + | + | ||
В | + | + | + | + | + | + | + | + | ||
Примечание - Методы исследований, отмеченные знаком "+", рекомендуются для разработки программы оценки соответствующих изделий. Однако их не следует рассматривать как обязательный перечень. | ||||||||||
В таблице 2 указаны методы, рекомендуемые для дополнительной оценки также в зависимости от категории изделия.
Таблица 2 - Дополнительные методы оценки биологического действия медицинских изделий
Категория изделий в зависимости от контакта с организмом человека | Метод исследований | |||||
Группа изделий | Вид контакта | Продолжительность контакта (см. 4.2): | Хрони- | Канце- | Репро- | Биоде- |
Изделия поверхностного контакта | Кожа | А | - | - | - | - |
Б | - | - | - | - | ||
В | - | - | - | - | ||
Слизистые оболочки | А | - | - | - | - | |
Б | - | - | - | - | ||
В | - | - | - | - | ||
Поврежденные, | А | - | - | - | - | |
Б | - | - | - | - | ||
В | - | - | - | - | ||
Изделия, присоединяемые извне | Непрямой кровоток | А | - | - | - | - |
Б | - | - | - | - | ||
В | + | + | - | - | ||
Мягкая ткань, кость, дентин | А | - | - | - | - | |
Б | - | - | - | - | ||
В | - | + | - | - | ||
Имплантируемые изделия | Мягкая ткань, кость | А | - | - | - | - |
Б | - | - | - | - | ||
В | + | + | - | - | ||
Кровь | А | - | - | - | - | |
Б | - | - | - | - | ||
В | + | + | - | - | ||
Примечание - Методы исследований, отмеченные знаком "+", рекомендуются для разработки программы оценки соответствующих изделий. Однако их не следует рассматривать как обязательный перечень. | ||||||
При разработке программы исследований изделий учитывают, что не все методы, указанные в таблицах для определенной категории, необходимы и применимы для каждого конкретного изделия.
Программу исследований планируют так, чтобы каждое изделие оценивали в соответствии с присущими ему качествами. При необходимости используют специально разработанные методы исследований, не указанные в таблицах.
В отчете о результатах исследований обосновывают выбор тех или иных методов.
7 Обеспечение достоверности и надежности результатов исследований
7.1 Гарантия достоверности и надежности используемых методов исследования
Используемые методы исследований должны быть чувствительными, точными, тщательно выполненными.
Результаты исследований должны быть воспроизводимыми при межлабораторном и внутрилабораторном контроле.
7.2 Гарантия применения материала для изготовления изделия и возможности длительного применения изделия в медицинской практике
Гарантию того, что материал применим для изготовления изделия, а также что изделие можно применять в медицинской практике в течение длительного времени, обеспечивают системой качества (см. приложение А, пояснение 7.2).
Примечание - В ГОСТ Р ИСО 9001 изложены требования к системам управления качеством. В ИСО 9004-1 представлено более подробное руководство по разработке и производству продукции.
ПРИЛОЖЕНИЕ А (справочное). Пояснения
ПРИЛОЖЕНИЕ А
(справочное)
А.1 Пояснения по стандарту в целом
Настоящий стандарт посвящен обеспечению безопасности использования медицинских изделий и материалов. Положения настоящего стандарта рассчитаны на такой подход к оценке биологического действия медицинских изделий, который рассматривает ее как обязательную часть общей оценки безопасности медицинских изделий и материалов и важный этап их разработки. Так же, как и остальные этапы процесса разработки, оценка нацелена на определение воздействия изделий и материалов на различные ткани организма человека при применении по назначению, а не в каких-либо специфических условиях.
В настоящем стандарте представлены классификация медицинских изделий, в которой выделены наиболее крупные категории, а также методы исследования биологического действия для каждой категории.
Так как диапазон возможного биологического риска обширен, нельзя рассматривать взаимодействие ткани с материалом изолированно от общей конструкции изделия. Использование самого лучшего с точки зрения взаимодействия с тканью материала может привести к ухудшению функциональных качеств изделия в целом. При этом взаимодействие с тканью - лишь одна из характеристик материала. Если условием применения по назначению является контакт с организмом человека, то влияние размеров изделия или его частей, контактирующих с соответствующими тканями, является обязательным предметом исследования. Обычно же в стандартах и руководствах, устанавливающих требования к разработке и производству изделий, влияние размеров изделия или его частей, контактирующих с тканями организма, не рассматривается.
Биологическое действие материала может быть нежелательным при его использовании в одном качестве применения и не быть таковым при использовании в другом качестве.
Несмотря на то, что изучение биологического действия медицинского изделия или материала опирается на методы с использованием животных, необходимо учитывать, что один и тот же материал может оказывать неодинаковое воздействие на ткани человека и животного. Кроме того, наличие у людей индивидуальных реакций позволяет предполагать возможное возникновение нежелательного эффекта при применении уже изученных материалов, имеющих стабильные характеристики. Поэтому по мере развития науки и понимания основных механизмов воздействия изделий и материалов предпочтение будут отдавать методам in vitro в тех случаях, когда они обеспечат равноценную информацию.
Применение чрезмерно жестких методов и критериев оценки может приводить либо к излишним ограничениям (запретам) в отношении применения изделий или материалов, либо к ложному представлению об опасности их использования.
Когда устанавливают особые требования к безопасности применения медицинского изделия или материала, специалисты в области исследований медицинских изделий и материалов могут использовать специальные методы и критерии оценки. В таком случае методы и критерии оценки устанавливают в нормативном документе на конкретное изделие или материал.
Настоящий стандарт не является набором обязательных требований и методов, предназначенных для лиц, не имеющих ни соответствующей подготовки, ни опыта. Положения настоящего стандарта следует применять с определенной долей интерпретации и взвешенности. На это способны специалисты, которые имеют подготовку и опыт в оценке биологического действия и которые будут учитывать факторы, относящиеся к изделию, материалу и предполагаемому назначению, а также будут учитывать информацию, полученную из литературы, лабораторного и клинического опыта.
А.2 Пояснения по разделам стандарта
Ниже даны пояснения к разделам (подразделам) настоящего стандарта. Нумерация разделов (подразделов) соответствует нумерации, принятой в основной части стандарта.
Раздел 1 Кроме характеристик биологического действия материала, существуют и другие важные характеристики, которые необходимо принимать во внимание при создании изделия.
3.6 Первичная оценка биологического действия медицинского изделия может включать в себя как изучение данных предшествующего опыта, так и экспериментальные исследования. Подобная оценка может позволить сделать следующий вывод: нет необходимости проводить экспериментальные исследования тогда, когда выбранный материал уже используют в качестве, аналогичном тому, в котором предполагают его использовать в создаваемом изделии.
Оценка должна учитывать предполагаемое и возможное неожиданное взаимодействие между материалом и тканями организма человека.
3.8 Цель данного подраздела - избежать проведения экспериментальных исследований в тех случаях, когда информацию о материале можно получить из иных источников.
7.2 Выбор и оценка материалов, которые будут контактировать с тканями организма человека, требуют такого системного подхода, при котором характеристики всех материалов, входящих в конечный продукт, будут учтены при общей оценке качества разработки изделия.
ПРИЛОЖЕНИЕ Б (справочное). Схема системного подхода к оценке биологического действия медицинских изделий
ПРИЛОЖЕНИЕ Б
(справочное)
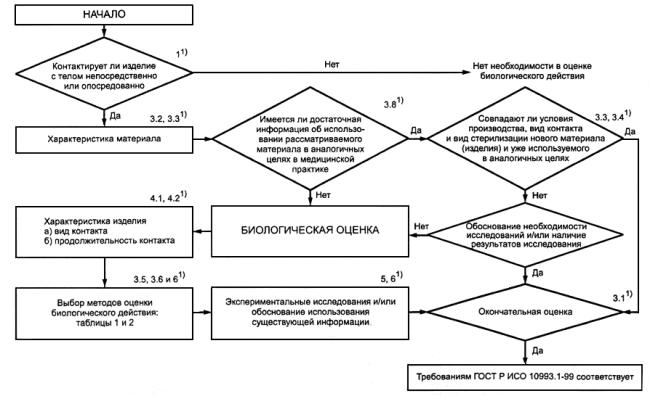
________________
* Ссылки на разделы (подразделы) настоящего стандарта.
ПРИЛОЖЕНИЕ В (справочное). Библиография
ПРИЛОЖЕНИЕ В
(справочное)
Международная организация по стандартизации (ИСО)
[1] ISO 7405:1997, Dentistry - Preclinical evaluation of biocompatibility of medical devices used in dentistry - Test methods for dental materials.
[2] ISO 9000-1:1994, Quality management and quality assurance standards - Part 1: Guidelines for selection and use.
[3] ISO 9001:1994, Quality systems - Model for quality assurance in design, development, production, installation and servicing.
[4] ISO 9004-4:1994, Quality management and quality system elements - Guidelines.
[5] ISO 10993-3:1992, Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity.
[6] ISO 10993-4:1992, Biological evaluation of medical devices - Part 4: Selection of tests for interaction with blood.
[7] ISO 10993-5:1992, Biological evaluation of medical devices - Part 5: Tests for cytotoxicity: in vitro methods.
[8] ISO 10993-6:1994, Biological evaluation of medical devices - Part 6: Tests for local effects after implantation.
[9] ISO 10993-9:*, Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products.
________________
* Будет опубликован. (Пересмотр ИСО/ТК 10993-9:1994).
[10] ISO 10993-10:1995, Biological evaluation of medical devices - Part 10: Tests for irritation and sensitization.
[11] ISO 10993-11:1993, Biological evaluation of medical devices - Part 11: Tests for systemic toxicity.
[12] ISO 13485:1996, Quality systems - Medical devices - Particular requirements for the application of ISO 9001.
[13] ISO 13488:1996, Quality systems - Medical devices - Particular requirements for the application of ISO 9002.
[14] ISO/IEC Guide 25:1990, General requirements for the competence of calibration and testing laboratories.
Организация по экономическому сотрудничеству и развитию (ОЭСР)
[15] Guidelines for testing of chemicals - Section 4: Health effects.
Национальные стандарты
[16] ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность.