ГОСТ 7983-99
Группа Р14
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПАСТЫ ЗУБНЫЕ
Общие технические условия
Toothpastes.
General specifications
МКС 11.120.10
ОКП 91 5821
Дата введения 2001-01-01
Предисловие
1 РАЗРАБОТАН Межгосударственным Техническим комитетом по стандартизации МТК 405 "Средства гигиены полости рта", Автономная некоммерческая организация "НИИ СНДВ"
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 16-99 от 8 октября 1999 г.)
За принятие проголосовали:
Наименование государства | Наименование национального органа по стандартизации |
Азербайджанская республика | Азгосстандарт |
Республика Армения | Армгосстандарт |
Республика Беларусь | Госстандарт Беларуси |
Грузия | Грузстандарт |
Киргизская Республика | Киргизстандарт |
Республика Казахстан | Госстандарт Республики Казахстан |
Республика Молдова | Молдовастандарт |
Российская Федерация | Госстандарт России |
Республика Таджикистан | Таджикгосстандарт |
Туркменистан | Главная государственная инспекция Туркменистана |
Украина | Госстандарт Украины |
3 Настоящий стандарт соответствует ИСО 11609-95 "Стоматология. Пасты зубные. Требования, методы испытания и маркировка" в части нормативных требований по водородному показателю, тяжелым металлам, фториду.
Методика определения общего фторида (приложение Б настоящего стандарта) и методика определения абразивноcти по Хефферрену (приложение В настоящего стандарта) представляют собой аутентичный текст ИСО 11609-95
4 Постановлением Государственного комитета Российской Федерации по стандартизации и метрологии от 3 февраля 2000 г. N 29-ст межгосударственный стандарт ГОСТ 7983-99 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 2001 г.
5 ВЗАМЕН ГОСТ 7983-82, кроме правил приемки, методов органолептических испытаний и п.3.8.
ВНЕСЕНА поправка, опубликованная в ИУС N 6, 2002 год
Поправка внесена юридическим бюро "Кодекс" по тексту ИУС N 6, 2002 год
1 Область применения
1 Область применения
Настоящий стандарт распространяется на зубные пасты, предназначенные для ухода за зубами и полостью рта.
Стандарт устанавливает общие технические требования к зубным пастам и методы испытаний.
Обязательные требования к качеству продукции, обеспечивающие ее безопасность для жизни, здоровья населения, изложены в 3.1.4, 3.3, 4 и разделе 6.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 61-75 Кислота уксусная. Технические условия
ГОСТ 199-78 Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 245-76 Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 908-79 Кислота лимонная пищевая. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2053-77 Натрий сернистый 9-водный. Технические условия
ГОСТ 2493-75 Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Кислота соляная. Технические условия
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 3652-69 Кислота лимонная моногидрат и безводная. Технические условия
ГОСТ 3760-79 Аммиак водный. Технические условия
ГОСТ 4145-74 Калий сернокислый. Технические условия
ГОСТ 4165-78 Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4172-76 Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4198-75 Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4204-77 Кислота серная. Технические условия
ГОСТ 4214-78 Кислота кремниевая водная. Технические условия
ГОСТ 4217-77 Калий азотнокислый. Технические условия
ГОСТ 4233-77 Натрий хлористый. Технические условия
ГОСТ 4236-77 Свинец (II) азотнокислый. Технические условия
ГОСТ 4328-77 Натрия гидроокись. Технические условия
ГОСТ 4332-76 Калий углекислый - натрий углекислый. Технические условия
ГОСТ 4461-77 Кислота азотная. Технические условия
ГОСТ 4463-76 Натрий фтористый. Технические условия
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ 5821-78 Кислота сульфаниловая. Технические условия
ГОСТ 5962-67 Спирт этиловый ректификованный. Технические условия
ГОСТ 6038-79 D-Глюкоза. Технические условия
ГОСТ 6259-75 Глицерин. Технические условия
ГОСТ 6563-75 Изделия технические из благородных металлов и сплавов. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6824-96 Глицерин дистиллированный. Технические условия
ГОСТ 8682-93 Посуда лабораторная стеклянная. Шлифы конические взаимозаменяемые
ГОСТ 8864-71 Натрий N, N-диэтилдитиокарбамат 3-водный. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9412-93 Марля медицинская. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10652-73 Соль динатриевая этилендиамин-N, N, N, N
-тетрауксусной кислоты, 2-водная (трилон Б). Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытания
ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 14192-96 Маркировка грузов
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 17206-96 Агар микробиологический. Технические условия
ГОСТ 19569-89 Стерилизаторы паровые медицинские. Общие технические требования и методы испытаний
ГОСТ 20015-88 Хлороформ. Технические условия
ГОСТ 22280-76 Натрий лимоннокислый 5,5-водный. Технические условия
ГОСТ 24104-88 Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 28303-89 Изделия косметические. Упаковка, маркировка, транспортирование и хранение
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29184-91 Продукты пищевые. Методы выявления и определения количества бактерий семейства Enterobacteriaceae
ГОСТ 29188.0-91 Изделия парфюмерно-косметические. Правила приемки, отбор проб, методы органолептических испытаний
ГОСТ 29188.2-91 Изделия косметические. Метод определения водородного показателя (рН)
ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
3 Технические требования
3.1 Характеристика
3.1.1 Зубные пасты представляют собой многокомпонентную систему, состоящую из абразивных, влагоудерживающих, связующих, ароматических веществ, воды, а также может содержать лечебно-профилактические, поверхностно-активные, вкусовые и консервирующие добавки в различных комбинациях. Зубные пасты выпускают в виде крема, геля или пасты. Различают гигиенические и лечебно-профилактические зубные пасты.
3.1.2 Зубные пасты должны вырабатывать в соответствии с требованиями настоящего стандарта, технологического регламента и по рецептурам, согласованным в установленном порядке.
3.1.3 Зубные пасты не должны содержать сахарозу и другие легкоферментируемые углеводы.
3.1.4 По органолептическим, физико-химическим, микробиологическим показателям зубные пасты должны соответствовать требованиям, указанным в таблице 1.
Таблица 1
Наименование показателя | Характеристика и норма |
1 Внешний вид и консистенция | Однородная масса, удерживающаяся на поверхности зубной щетки, не проникая внутрь щетины (за исключением случаев, когда неоднородность массы и иная консистенция обусловлены рецептурой или заявлены изготовителем) |
2 Цвет | Свойственный цвету пасты данного наименования |
3 Запах | Свойственный запаху пасты данного наименования |
4 Вкус | Свойственный вкусу пасты данного наименования |
5 Микробиологическая чистота: | |
Общее количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, КОЕ/1 г, не более | 1х10 |
Семейство: | |
Enterobacteriaceae, КОЕ/1 г | Отсутствие |
Pseudomonas aeruginosa, КОЕ/1 г | Отсутствие |
Staphylococcus aureus, КОЕ/1 г | Отсутствие |
Плесневые грибы и дрожжи, КОЕ/1 г | Отсутствие |
6 Водородный показатель (рН) | 5,5-10,5 |
7 Массовая доля суммы тяжелых металлов, %, не более | 0,002 |
8 Массовая доля фторида (в расчете на молярную массу фтора), % | 0,05-0,15 |
9 Масса фторида (в расчете на молярную массу фтора) в единице упаковки, мг, не более | 300 |
10 Абразивность | Выдерживает испытание по 6.10 |
Примечание - Массовую долю фторида определяют во фторидсодержащей зубной пасте. | |
3.1.5 Допускается по согласованию с Министерством здравоохранения выпускать лечебно-профилактические зубные пасты специального назначения с рН 4,5-5,5 после испытаний на деминерализацию эмали.
3.1.6 Для зубных паст, предназначенных для детей в возрасте от 1 до 6 лет, рекомендуется уменьшение массовой доли фторида до 0,02-0,05%.
3.2 Требования к сырью и материалам
Сырье и материалы для приготовления зубных паст должны соответствовать требованиям нормативных документов.
3.3 Маркировка
3.3.1 На потребительской таре с зубной пастой указывают:
- наименование, название (при наличии) и назначение изделия;
- наименование и местонахождение изготовителя, местонахождение организации, уполномоченной изготовителем на принятие претензий от потребителя;
- товарный знак изготовителя (при наличии);
- масса нетто, объем;
- состав изделия;
- массовую долю фторида (для фторидсодержащих зубных паст);
- условия хранения (для продукции, требующей специальных условий хранения);
- срок годности (срок годности может быть указан следующим образом: "годен (использовать) до (месяц, год)" или "срок годности (месяцев, лет) с обязательным указанием в последнем случае даты изготовления (месяц, год)";
- обозначение настоящего стандарта (если это предусмотрено законодательными документами страны-изготовителя);
- информация о сертификации;
- информация об эффективном применении и меры предосторожности.
Маркировку наносят на языке страны-импортера. Дополнительно информацию допускается наносить на языке страны-изготовителя.
3.3.2 Маркировка транспортной тары в соответствии с требованиями ГОСТ 14192, ГОСТ 28303
3.4 Упаковка
3.4.1 Зубные пасты фасуют в потребительскую тару, обеспечивающую сохранность зубной пасты.
3.4.2 Масса пасты в единице упаковки должна соответствовать массе, установленной технической документацией и не должна превышать 200 г. Допускается отклонение, не превышающее ±5% от установленной массы.
3.4.3 Тара и упаковочные средства должны быть изготовлены из материалов, разрешенных органами санитарно-эпидемиологического надзора для контакта с пищевыми продуктами, обеспечивающих сохранность зубной пасты в течение срока годности и не взаимодействующих с зубными пастами.
3.4.4 Транспортная упаковка в соответствии с требованиями ГОСТ 28303.
4 Требования безопасности
Зубные пасты должны быть токсикологически и клинически безопасны. Они не должны оказывать неблагоприятного воздействия на ткани полости рта и не должны вызывать изменений в количественном и качественном составе нормальной микрофлоры полости рта при соблюдении условий хранения на протяжении срока годности.
5 Правила приемки
5.1 Зубные пасты принимают по ГОСТ 29188.0.
5.2 Абразивность определяют, если в рецептуре зубной пасты в качестве абразивного наполнителя используется вещество, показатели абразивности которого отсутствуют.
6 Методы испытаний
Отбор проб проводят по ГОСТ 29188.0, раздел 2.
Для проведения испытаний масса объединенной пробы - не менее 300 г.
Для составления объединенной пробы зубную пасту из туб помещают в банки, тщательно перемешивают шпателем и плотно закрывают крышками.
Для проведения физико-химических испытаний из пробы отбирают навески.
Отбор проб для определения микробиологической чистоты проводят по 6.5.4.
6.1 Определение внешнего вида и консистенции по ГОСТ 29188.0, раздел 3.
6.2 Определение цвета по ГОСТ 29188.0, раздел 3.
6.3 Определение запаха по ГОСТ 29188.0, раздел 3.
6.4 Определение вкуса органолептически.
6.5 Определение микробиологической чистоты
Метод основан на посеве разведения навески зубной пасты в питательные среды с последующим культивированием посевов в условиях, благоприятных для роста микроорганизмов.
Приемо-сдаточные испытания на микробиологическую чистоту включают:
- определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
При контрольных испытаниях дополнительно проводят:
- определение присутствия (отсутствия) бактерий семейств Enterobacteriaceae, Pseudomonas aeruginosa (Р. aeruginosa), Staphylococcus aureus (S. aureus).
- определение присутствия (отсутствия) плесневых грибов и дрожжей.
6.5.1 Аппаратура
Для работы применяют обычное оборудование микробиологических лабораторий.
Стерилизатор паровой медицинский по ГОСТ 19569.
Дистиллятор электрический ДЭ-4 или другой марки.
Стерилизатор воздушный.
Аппарат для встряхивания жидкости.
Термостаты, позволяющие поддерживать температуру (30±1) °С и (37±1) °С.
Микроскоп биологический.
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Баня водяная или другое подобное устройство, позволяющее поддерживать температуру (45±0,5) °С.
Лупа с 5-кратным увеличением по ГОСТ 25706.
рН-метр любой марки с набором электродов с погрешностью измерения ±0,1 рН.
Холодильник бытовой электрический по ГОСТ 26678.
Таймер.
Электроплитка по ГОСТ 14919.
Чашки Петри стеклянные (или пластмассовые одноразовые) диаметром от 90 до 100 мм по ГОСТ 25336.
Пипетки дозирующие вместимостью 1,5 и 10 см по ГОСТ 29227.
Пробирки бактериологические по ГОСТ 25336.
Колбы стеклянные вместимостью 100, 200, 500 и 1000 см по ГОСТ 1770.
Бутылки стеклянные для хранения реактивов.
Ступки фарфоровые с пестиками по ГОСТ 9147.
Стекла предметные для микропрепаратов по ГОСТ 9284.
Стекла покровные по ГОСТ 6672.
Облучатель бактерицидный потолочный ОБИ-300 или другой марки.
Марля медицинская по ГОСТ 9412.
6.5.2 Питательные среды и реактивы
Агар микробиологический по ГОСТ 17206.
Агар сухой питательный по ФС 42-188ВС-90.
Агар мясо-пептонный с глюкозой, приготовленный по ГОСТ 10444.1.
Агар яично-желточно-солевой, приготовленный по ГОСТ 10444.1.
Вода мясная по ГОСТ 20729.
Вода дистиллированная по ГОСТ 6709.
Глицерин дистиллированный по ГОСТ 6824.
Глюкоза по ГОСТ 6038.
Маннит по ГОСТ 8321.
Калий сернокислый по ГОСТ 4145.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Магний хлорнокислый безводный по ГФ, XI изд.
Натрия гидроокись по ГОСТ 4328, раствор концентрации с (NаОN)=1,0 моль/дм (1 н.).
Натрий хлористый по ГОСТ 4233.
Натрий фосфорнокислый однозамещенный 2-водный по ГОСТ 245.
Пептон сухой ферментативный по ГОСТ 13805.
Спирт этиловый ректификованный по ГОСТ 5962.
Феноловый красный, индикатор, по ГФ, XI изд.
Малахитовый зеленый, индикатор, по ГФ, XI изд.
Левомицетин по ГФ, XI изд.
Калий фосфорнокислый двузамещенный 3-водный по ГОСТ 2493.
Натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172.
Калий азотнокислый по ГОСТ 4217.
Кислота соляная по ГОСТ 3118, раствор концентрации с (НСl)=1,0 моль/дм (1 н.).
Кислота сульфаниловая по ГОСТ 5821.
Кислота уксусная по ГОСТ 61.
Нафтол-1, спиртовой раствор массовой долей 1% по ГОСТ 5838.
Нафтиламин по ГОСТ 8827.
N, N-диметил--фенилендиамин дихлорид, раствор массовой долей 1%.
Масло иммерсионное для микроскопирования по ГОСТ 13739.
Масло вазелиновое медицинское по ГОСТ 3164.
Плазма кролика сухая цитратная для реакции плазмокоагуляции.
Питательная среда N 1 (для культивирования аэробных и факультативно-анаэробных микроорганизмов), сухая [1].
Питательная среда N 2 (для выращивания плесневых грибов), сухая (Сабуро) [2].
Питательная среда N 3 (для обогащения бактерий семейства Enterobacteriaceae), сухая [3].
Питательная среда N 4 (для выделения Enterobacteriaceae) сухая (Агар Эндо) [4].
Питательная среда N 6 (для определения ферментации глюкозы), сухая [5].
Питательная среда N 7 (для определения редукции нитратов в нитриты) сухая [6].
Питательная среда N 8 (для выращивания P.aeruginosa и S.aureus), сухая [7].
Питательная среда N 9 (для выделения пигмента пиоцианита P.aeruginosa), сухая [8].
Питательная среда N 10 (для идентификации S.aureus), сухая [9].
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов и питательных сред по качеству не ниже вышеуказанных.
6.5.3 Приготовление растворов и питательных сред
6.5.3.1 Общие требования при подготовке растворов и питательных сред
Для приготовления растворов и питательных сред следует использовать обеззараженные основные компоненты, сухие питательные среды или готовые среды в стерильной упаковке, изготовленные на специализированных предприятиях, дистиллированную или деионизированную воду.
Измерения рН следует производить при 25 °С или с использованием термокомпенсатора.
Доведение рН среды до нужного уровня осуществляют с помощью растворов гидроокиси натрия и соляной кислоты.
Жидкости для разведения и питательные среды стерилизуют в автоклаве или кипячением (дробно).
Готовые среды хранят в сухом темном месте при температуре от 0 °С до 4 °С не более 1 мес. При приготовлении и использовании питательных сред необходимо соблюдать следующие правила:
- твердые компоненты среды растворяют в воде, подогревая в случае необходимости (в первую очередь питательные основы и соли, в последнюю - сахара);
- жидкие питательные среды должны быть прозрачными;
- продолжительность выдерживания питательного агара в кипящей водяной бане при его расплавлении не должна превышать 45-60 мин;
- необходимо проверять стерильность каждой партии питательной среды.
6.5.3.2 Физиологический раствор
0,85 г хлористого натрия растворяют в 100 см дистиллированной воды и стерилизуют 20 мин при (120±1) °С.
Срок хранения физиологического раствора 14 дней.
6.5.3.3 Буферный раствор, рН 7,0
1,0 г сухого пептона, 4,30 г хлористого натрия, 7,23 г фосфорнокислого двузамещенного натрия и 3,56 г фосфорнокислого однозамещенного калия растворяют при нагревании в 1000 см дистиллированной воды, фильтруют через бумажный фильтр, устанавливают рН 7,0, разливают в колбы по 250 см
, стерилизуют 20 мин при (112±1) °С.
6.5.3.4 Феноловый красный, индикатор, раствор массовой долей 1%
1,0 г фенолового красного растирают в ступке, добавляя небольшими порциями 28,2 см раствора гидроокиси натрия концентрации 0,1 моль/дм
. Полученный раствор переносят в мерную колбу вместимостью 100 см
, доливают водой до метки.
Хранят во флаконе из темного стекла при 4-10 °С.
6.5.3.5 Малахитовый зеленый, индикатор, раствор массовой долей 0,5%
0,5 г красителя переносят в стерильный флакон, заливают 100 см стерильной горячей дистиллированной воды, помещают на сутки в термостат, периодически взбалтывая. Готовый раствор хранят во флаконе из темного стекла при 4-10 °С.
6.5.3.6 Среда для культивирования аэробных и факультативно-анаэробных микроорганизмов
10 г пептона и 5 г хлористого натрия растворяют при нагревании в 1000 см мясной воды, добавляют 1 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, вносят 13-15 г заранее замоченного агара, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью не более 500 см
, заполняя их примерно наполовину. Стерилизуют 20 мин при (121±1) °С.
рН после стерилизации - 7,2±0,2.
Допускается использовать сухой питательный агар, мясо-пептонный агар с глюкозой, приготовленные по ГОСТ 10444.1, или сухую среду N 1 [1].
6.5.3.7 Среда для выращивания плесневых грибов (Среда Сабуро) и дрожжей
Готовят согласно ГОСТ 10444.1
Допускается использовать сухую среду N 2 [2].
6.5.3.8 Среда обогащения для бактерий семейства Enterobacteriaceae
10 г пептона, 7,5 г фосфорнокислого двузамещенного натрия, 2,5 г фосфорнокислого однозамещенного калия растворяют в 1000 см мясной воды при нагревании, добавляют 10 г глюкозы, прибавляют 8 см
раствора фенолового красного (6.5.3.4) и 3 см
раствора малахитового зеленого (6.5.3.5), устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в колбы вместимостью 100 см
и стерилизуют 20 мин при (112±1) °С.
рН после стерилизации - 7,2±0,2.
Допускается использовать сухую среду N 3 [3].
6.5.3.9 Агар Эндо сухой для обнаружения бактерий семейства Enterobacteriaceae
Готовят согласно ГОСТ 29184, допускается использовать сухую среду N 4 [4].
6.5.3.10 Среда для определения ферментации глюкозы
10 г пептона и 5 г хлористого натрия растворяют в 1000 см мясной воды при нагревании, вносят 40 г глюкозы, добавляют 8 см
раствора фенолового красного (6.5.3.4), устанавливают рН 7,3; кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки по 4-5 см
и стерилизуют 20 мин при (112±1) °С. По окончании стерилизации среду быстро охлаждают.
рН после стерилизации - 7,2±0,2.
Допускается использовать сухую среду N 6 [5].
6.5.3.11 Среда для определения редукции нитратов в нитриты
5 г пептона, 5 г хлористого натрия, 1,5 г азотнокислого калия растворяют в 1000 см дистиллированной воды при нагревании, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки по 4-5 см
и стерилизуют 20 мин при (121±1) °С.
рН после стерилизации - 7,2±0,2.
Допускается использовать сухую среду N 7 [6].
6.5.3.12 Реактив Грисса
Раствор 1. 0,5 г сульфаниловой кислоты растворяют в 30 см ледяной уксусной кислоты, фильтруют. Раствор годен в течение 7 дн.
Раствор 2. 0,1 г 1-нафтиламина растворяют в 100 см кипящей воды, охлаждают, добавляют 30 см
ледяной уксусной кислоты, фильтруют. Раствор годен в течение 7 дн.
Перед употреблением смешивают равные объемы растворов 1 и 2.
6.5.3.13 Реактив на цитохромоксидазу
Раствор 1. Спиртовой раствор нафтола-1 массовой долей 1%.
Раствор 2. Раствор N, N-диметил--фенилендиамина дигидрохлорида в воде массовой долей 1%.
Перед употреблением смешивают растворы 1 и 2 в соотношении -2:3.
Растворы годны в течение 14 дн при хранении в холодильнике во флаконах из темного стекла.
6.5.3.14 Среда для выращивания P.aeruginosa и S.aureus
10 г пептона, 5 г хлористого натрия, 2,5 г фосфорнокислого двузамещенного калия растворяют в 1000 см дистиллированной воды при нагревании, вносят 2,5 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают по 100 см
в колбы и стерилизуют 20 мин при (112±1) °С.
рН после стерилизации - 7,2±0,2.
Допускается использовать любой питательный бульон (рН 7,2) или сухую среду N 8 [7].
6.5.3.15 Среда для выявления пигмента пиоцианина P.aeruginosa
20 г пептона, 1,4 г безводного магния хлорнокислого, 10 г сернокислого калия вносят в 1000 см дистиллированной воды и оставляют на 15 мин, перемешивают, растворяют при нагревании. Добавляют 10 см
глицерина, устанавливают рН 7,3, кипятят 1 мин, прибавляют 15 г агара, замоченного заранее, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают по 100 см
во флаконы и стерилизуют 20 мин при (121±1) °С.
рН после стерилизации - 7,2±0,2.
Допускается использовать сухую среду N 9 [8].
6.5.3.16 Среда для идентификации S. aureus (маннитно-солевой агар)
10 г пептона, 75 г хлористого натрия, 10 г маннита растворяют при нагревании в 1000 см дистиллированной воды, добавляют 2,5 см
раствора фенолового красного (6.5.3.4), устанавливают рН 7,3, кипятят 1 мин, добавляют замоченный заранее агар, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью 500 см
и стерилизуют 20 мин при (121±1) °С.
рН после стерилизации - 7,4±0,2.
Допускается использовать сухую среду N 10 [9] или яично-желточно-солевой агар, приготовленный по ГОСТ 10444.1.
6.5.3.17 Проверка стерильности питательных сред
Пробирки, флаконы, колбы со средами после стерилизации инкубируют в термостате при (35±1) °С 72 ч. Использованию подлежат среды без признаков микробного роста.
Допускается совмещать проверку на стерильность среды с проведением анализа, устанавливая контрольные пробы (чашки или пробирки со средой данной партии) рядом с анализируемыми.
6.5.4 Отбор проб и подготовка пробы к испытанию
Из каждой партии зубных паст готовят образец для анализа (среднюю пробу) минимум из 5 разных упаковок. При повторном анализе пробу готовят из 5 других упаковок.
Перед вскрытием упаковки горлышко тубы протирают тампоном, смоченным этиловым спиртом, и вскрывают стерильным пинцетом перед пламенем горелки.
Небольшую порцию пасты (2-3 г), непосредственно прилегающую к отверстию, выдавливают в отдельную посуду и выбрасывают.
Навески по 100 г из 5 разных упаковок (всего 50 г) вносят в стерильную градуированную колбу вместимостью 250 см и постепенно добавляют буферный раствор до 100 см
, помешивая стерильной стеклянной палочкой, что будет соответствовать разведению 1:2 (1-е разведение).
После энергичного смешивания в аппарате для встряхивания жидкости или вручную в течение 5-10 мин из полученной суспензии готовят последовательные разведения образца 1:10 (2-е разведение: 20 см 1-го разведения плюс 80 см
буферного раствора) и 1:100 (3-е разведение: 10 см
2-го разведения плюс 90 см
буферного раствора). Посев осуществляют через 30 - 45 мин после окончательного разведения образца.
6.5.5 Проведение испытаний
6.5.5.1 Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Метод основан на выявлении и количественном подсчете всех выросших колоний микроорганизмов при культивировании посевов в аэробных условиях на питательных средах определенного состава при инкубации в течение 72 ч при (30±1) °С.
Испытание проводят глубинным методом посева в плотные среды в соответствии с ГОСТ 26670.
Исследуемый образец в разведении 1:10 и 1:100, приготовленный по 6.5.4, вносят по 1 см в стерильные чашки Петри (по две на каждое разведение).
Чашки заливают расплавленной и охлажденной до 40-50 °С средой по 6.5.3.6. Содержимое чашек быстро и осторожно перемешивают вращательными движениями, дают застыть и переворачивают чашки.
Посевы инкубируют при (30±1) °С в течение 72 ч, после чего проводят подсчет колоний в соответствии с ГОСТ 26670.
6.5.5.2 Выявление и идентификация бактерий семейства Enterobacteriaceae
Метод основан на выявлении бактерий семейства Enterobacteriaceae с использованием накопительных и селективных агаризованных питательных сред с дальнейшей идентификацией выявленных бактерий по биохимическим тестам, являющимся основой современной классификации кишечных бактерий.
В колбу с 100 см среды обогащения по 6.5.3.8 (среда N 3) вносят 10 см
исследуемого образца в разведении 1:10 и перемешивают.
Посевы инкубируют при (37±1) °С в течение 24-48 ч.
При наличии роста (помутнение среды и изменение ее цвета из красного в желтый при расщеплении глюкозы) делают пересев петлей на чашки с агаром Эндо по 6.5.3.9.
Посевы на указанную среду инкубируют при (37±1) °С 24 ч.
При отсутствии роста на селективных агаризованных средах, типичных для семейства Enterobacteriaceae колоний (см. таблицу 2) считают, что в образце нет представителей данного семейства.
Таблица 2 - Морфологическая характеристика бактерий семейства Enterobacteriaceae на дифференциально-диагностической среде N 4 (агар Эндо)
Характерная морфология колоний | Микроскопия окрашенных препаратов |
Круглые малиновые с металлическим блеском или без него; розовые, бесцветные, блестящие, выпуклые, диаметром 2-4 мм | Грамотрицательные неспоровые палочки |
Подозрительные по морфологии колонии пересевают (каждую отдельно) на скошенную в пробирках среду по 6.5.3.6 и инкубируют их при (37±1) °C 24 ч.
Из каждой пробирки с чистой культурой готовят мазки и делают пересев на среды по 6.5.3.10 и 6.5.3.11. В половину пробирок со средой по 6.5.3.10 вносят по 0,5 см стерильного вазелинового масла.
Все посевы инкубируют при (37±1) °C в течение 20-24 ч.
Изменение цвета среды по 6.5.3.10 с вазелиновым маслом из красного в желтый свидетельствует о ферментации глюкозы исследуемой культурой.
Появление красного окрашивания среды по 6.5.3.11 при внесении в нее реактива Грисса свидетельствует о редукции нитратов в нитриты.
Параллельно исследуют чистые культуры на наличие фермента цитохромоксидазы с помощью реактива по 6.5.3.13.
На полоску фильтровальной бумаги, смоченной специальным реактивом, наносят петлей или стеклянной палочкой суточную исследуемую культуру бактерий. Синее окрашивание, появляющееся через 2-5 мин, свидетельствует о положительной оксидазной реакции.
Если в образце обнаружены грамотрицательные неспоровые палочки, которые дают отрицательную оксидазную реакцию, ферментируют глюкозу с образованием кислоты (или кислоты и газа) и восстанавливают нитраты в нитриты - препарат содержит бактерии семейства Enterobacteriaceae.
6.5.5.3 Выявление и идентификация Pseudomonas aeruginosa, Staphylococcus aureus
Метод выявления P.aeruginosa и S.aureus основан на использовании общей жидкой питательной среды и селективных агаризованных питательных сред, рекомендованных для этих видов бактерий, с последующей идентификацией выделенных микроорганизмов с помощью биохимических тестов.
В колбу со 100 см среды по 6.5.3.14 (среда N 8) вносят 10 см
исследуемого образца в разведении 1:10 и перемешивают.
Посевы инкубируют при (37±1) °C в течение 24-48 ч.
При наличии роста делают пересев петлей на среды по 6.5.3.15 и 6.5.3.16, разлитые в чашки Петри.
Новые посевы инкубируют при (37±1) °C в течение 24-48 ч.
При отсутствии на чашках со средами по 6.5.3.15 (среда N 9) и 6.5.3.16 (среда N 10) подозрительных колоний, соответствующих морфологической характеристике, данной в таблицах 3 и 4, считают, что в образце нет бактерий P.aeruginosa и S.aureus.
Таблица 3 - Морфологическая характеристика P.Aeruginosa на дифференциально-диагностической среде N 9
Характерная морфология колоний | Микроскопия окрашенных препаратов |
Зеленоватые флюоресцирующие колонии, голубые в ультрафиолетовом свете | Грамотрицательные неспоровые палочки |
Таблица 4 - Морфологическая характеристика S.aureus на дифференциально-диагностической среде N 10
Характерная морфология колоний | Микроскопия окрашенных препаратов |
Желтые колонии, окруженные желтыми зонами | Грамположительные кокки, расположенные гроздьями |
При наличии на среде N 9 (6.5.3.15) зеленоватых флюоресцирующих колоний грамотрицательных неспоровых палочек, выделяющих сине-зеленый пигмент в питательный агар, культуру исследуют на наличие фермента цитохромоксидазы.
Если в образце обнаружены грамотрицательные неспоровые палочки, дающие положительную оксидазную реакцию и образующие сине-зеленый пигмент пиоцианин, препарат содержит Р.aeruginosa.
Наличие на среде N 10 (6.5.3.16) золотисто-желтых колоний грамположительных кокков, окруженных желтыми зонами, свидетельствует о ферментации маннита. Чистую культуру стафилококка исследуют на наличие фермента плазмокоагулазы.
Если в образце обнаружены грамположительные кокки, которые ферментируют маннит и дают положительную реакцию плазмокоагуляции, препарат содержит S.aureus.
Для постановки реакции плазмокоагуляции используют сухую кроличью цитратную плазму, которую разводят согласно инструкции по применению.
Общая схема выделения и идентификации микроорганизмов представлена в приложении А.
6.5.5.4 Выявление плесневых грибов и дрожжей
Метод основан на выявлении жизнеспособных плесневых грибов и дрожжей по характерным для них признакам роста на благоприятных питательных средах и морфологии клеток при микроскопировании.
10 см исследуемого образца в разведении 1:10 вносят в колбу со 100 см
жидкой питательной среды по 6.5.3.7 (среда Сабуро).
Посевы инкубируют при (30±1) °C в течение 5 сут, ежедневно контролируя появление признаков роста микроорганизмов.
В летний период допускается выдерживать посевы при 20-25 °С.
При наличии роста (помутнение среды, осадок, пленка, комочки, нити) делают пересев петлей на плотную питательную среду по 6.5.3.7 и готовят препараты для микроскопирования.
При отсутствии роста плесневых грибов и дрожжей в посевах считают, что в образце нет представителей этой группы микроорганизмов.
При обнаружении на питательных средах признаков роста дрожжей или плесеней и после подтверждения их присутствия микроскопированием указывают на наличие последних в зубной пасте.
6.6 Определение водородного показателя (рН) по ГОСТ 29188.2 в водной суспензии массовой долей зубной пасты 25%
6.7 Определение массовой доли суммы тяжелых металлов
Массовую долю суммы тяжелых металлов определяют с N, N-диэтилдитиокарбаматом натрия электрофотометрическим методом (арбитражный метод) по 6.7.1, с N, N-диэтилдитиокарбаматом натрия визуально-колориметрическим методом по 6.7.2, с сернистым натрием визуальноколориметрическим методом по 6.7.3.
Допускается использовать для анализа атомно-адсорбционный метод по ГОСТ 30178-96.
6.7.1 Определение массовой доли суммы тяжелых металлов с N, N-диэтилдитиокарбаматом натрия электрофотометрическим методом (арбитражный)
Метод основан на электрофотометрическом измерении оптической плотности окрашенного раствора карбамата меди, полученного после обменной реакции диэтилдитиокарбаматов тяжелых металлов с раствором сернокислой меди.
6.7.1.1 Аппаратура и реактивы
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Фотоэлектроколориметр типа КФК-3, обеспечивающий измерение оптической плотности при длине волны 400-450 нм.
Электроплитка по ГОСТ 14919.
Печь муфельная, обеспечивающая автоматическое регулирование температуры 400-450 °С.
Тигель высокий 3 по ГОСТ 9147.
Колбы 1(2)-50, 100, 1000-2 по ГОСТ 1770.
Цилиндры 1-5, 25, 50 по ГОСТ 1770.
Пипетки 6(7)/-1-5, 10 по ГОСТ 29227.
Воронка ВЛ-1(3)-250 ХС по ГОСТ 25336.
Воронка В-75-110 ХС по ГОСТ 25336.
Стакан В-1-250 ХС по ГОСТ 25336.
Фильтр "белая лента".
Бумага индикаторная универсальная.
Аммиак водный по ГОСТ 3760.
Кислота соляная по ГОСТ 3118, раствор 1:1.
Натрия N, N-диэтилдитиокарбамат по ГОСТ 8864, свежеприготовленный раствор массовой долей 1,0%.
Натрий лимоннокислый 5,5-водный по ГОСТ 22280, раствор массовой долей 4,0%.
Хлороформ технический по ГОСТ 20015 или медицинский.
Натрия гидроокись по ГОСТ 4328, раствор массовой долей 0,01%.
Медь сернокислая по ГОСТ 4165, раствор массовой долей 5,0%.
Вода дистиллированная по ГОСТ 6709.
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не ниже вышеуказанных.
6.7.1.2 Приготовление растворов меди
6.7.1.2.1 Приготовление раствора А
В мерной колбе вместимостью 1000 см растворяют в воде 0,3929 г сернокислой меди, доливают до метки водой и перемешивают. 1 см
раствора А содержит 0,1 мг меди.
6.7.1.2.2 Приготовление раствора Б
В мерную колбу вместимостью 100 см вносят пипеткой 20 см
раствора А, доливают до метки водой и перемешивают.
1 см раствора Б содержит 0,02 мг меди, что соответствует раствору сравнения массовой долей меди 0,002%.
6.7.1.3 Построение градуировочного графика
В делительные воронки вносят пипеткой 0; 1; 2; 3; 4; 5; 6; 7 см раствора Б, что соответствует 0; 0,02; 0,04; 0,06; 0,08; 0,10; 0,12; 0,14 мг меди.
В каждую воронку приливают 5 см раствора диэтилдитиокарбамата натрия и перемешивают. Через 15 мин приливают 15 см
хлороформа, закрывают воронку пробкой и энергично встряхивают в течение 2 мин, периодически открывая пробку. После разделения слоев хлороформный экстракт диэтилдитиокарбамата меди, окрашенный в желтый цвет, сливают в мерную колбу вместимостью 50 см
. Проводят повторную экстракцию, приливая к оставшемуся водному слою еще 15 см
хлороформа, после разделения слоев хлороформный экстракт сливают в ту же мерную колбу. Содержимое мерной колбы доводят хлороформом до метки и перемешивают.
Через 5 мин измеряют оптическую плотность полученного раствора на фотоэлектроколориметре при длине волны 500-450 нм в кювете толщиной поглощающего свет слоя 20 мм. В качестве раствора сравнения применяют раствор, не содержащий меди.
Для построения градуировочного графика берут среднее арифметическое результатов трех измерений оптической плотности каждого раствора с известной массой меди. По полученным средним значениям оптической плотности растворов и соответствующим им массам меди в миллиграммах строят градуировочный график.
6.7.1.4 Подготовка пробы к испытанию
В тигле взвешивают 5,0 г зубной пасты, прокаливают в муфельной печи в течение 3 ч при 400-450 °С.
После охлаждения содержимое тигля переносят в стакан, тигель ополаскивают раствором соляной кислоты (15 см), раствор сливают в стакан и нагревают до кипения, затем охлаждают, нейтрализуют аммиаком до рН 7,0-7,5 по универсальной индикаторной бумаге и фильтруют в делительную воронку, отфильтровывая осадок гидроокисей железа и алюминия. Осадок на фильтре промывают 2 раза дистиллированной водой по 10 см
.
К фильтрату в делительной воронке приливают 5 см раствора лимоннокислого натрия, 5 см
раствора диэтилдитиокарбамата натрия и перемешивают. Через 15 мин проводят двукратную экстракцию карбаматов тяжелых металлов хлороформом в тех же условиях, как при построении градуировочного графика (6.7.1.3).
Хлороформные экстракты сливают во вторую делительную воронку, в которую приливают 50 см промывного раствора гидроокиси натрия для удаления избытка диэтилдитиокарбамата натрия, воронку закрывают пробкой и энергично встряхивают в течение 2 мин. После полного расслоения промытый хлороформный экстракт сливают в третью делительную воронку, в которую приливают 10 см
раствора сернокислой меди, закрывают воронку пробкой и встряхивают в течение 3 мин. После разделения слоев хлороформный экстракт сливают в мерную колбу вместимостью 50 см
, водный слой промывают еще 10 см
хлороформа, который сливают в ту же мерную колбу. Содержимое мерной колбы доводят до метки хлороформом, перемешивают и через 5 мин измеряют оптическую плотност
6.7.1.5 Проведение испытания
Оптическую плотность раствора, полученного по 6.7.1.4, измеряют на фотоэлектроколориметре, как указано в 6.7.1.3. Раствором сравнения служит раствор контрольного опыта, проведенный через все стадии испытания.
По оптической плотности раствора по градуировочному графику находят массу меди в миллиграммах, по которой рассчитывают массовую долю суммы тяжелых металлов в зубной пасте по 6.7.1.6.
6.7.1.6 Обработка результатов
Массовую долю суммы тяжелых металлов %, или
млн
(мг/кг), вычисляют по формулам
![]() (1)
(1)
![]() (2)
(2)
где - масса меди, найденная по градуировочному графику, мг;
1000 - масса навески зубной пасты, мг.
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,0003%, расхождение между результатами измерений в двух лабораториях не должно превышать 0,0007%, абсолютная погрешность измерения ±0,0004% при вероятности Р=0,95.
6.7.2 Определение массовой доли суммы тяжелых металлов с N, N-диэтилдитиокарбаматом натрия визуально-колориметрическим методом
Метод основан на визуальном сравнении окрашенного раствора карбамата меди, полученного после обменной реакции диэтилдитиокарбаматов тяжелых металлов и сернокислой меди с раствором сравнения.
6.7.2.1 Аппаратура и реактивы по 6.7.1.1 со следующим дополнением.
Пробирки для колориметрирования
6.7.2.2 Приготовление растворов меди по 6.7.1.2.
6.7.2.3 Приготовление раствора сравнения
В делительную воронку вносят пипеткой 1 см раствора Б (6.7.1.2.2) массовой долей меди 0,002%, приливают 5 см
раствора диэтилдитиокарбамата натрия и перемешивают. Через 15 мин приливают 15 см
хлороформа, закрывают воронку пробкой и энергично встряхивают в течение 2 мин, периодически открывая пробку. После разделения слоев хлороформный экстракт диэтилдитиокарбамата меди, окрашенный в желтый цвет, сливают в мерную колбу вместимостью 50 см
. Проводят повторную экстракцию, приливая к оставшемуся водному слою еще 15 см
хлороформа, после разделения слоев хлороформный экстракт сливают в ту же мерную колбу. Содержимое мерной колбы хлороформом доводят до метки и перемешивают.
6.7.2.4 Подготовка пробы к испытанию
В тигле взвешивают 1,00 г зубной пасты и прокаливают в муфельной печи в течение 3 ч при 400-450 °С.
Дальнейшую обработку проводят по 6.7.1.4.
6.7.2.5 Проведение испытания
По 20 см растворов, полученных по 6.7.2.3 и 6.7.2.4, наливают в пробирки для колориметрирования и сравнивают окраску хлороформных экстрактов просмотром на фоне листа белой бумаги в проходящем свете.
6.7.2.6 Обработка результатов
Зубную пасту считают соответствующей требованиям настоящего стандарта, если окраска хлороформного экстракта зубной пасты не будет интенсивнее окраски хлороформного экстракта раствора Б (раствор сравнения).
6.7.3 Определение массовой доли суммы тяжелых металлов с сернистым натрием визуально-колориметрическим методом
Метод основан на визуальном сравнении интенсивности окраски растворов сульфидов тяжелых металлов с раствором сравнения - сульфидом свинца.
6.7.3.1 Аппаратура и реактивы
Печь муфельная, обеспечивающая автоматическое регулирование температуры 450-500 °С.
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Пробирки по ГОСТ 25336.
Пробирки для колориметрирования.
Пипетки по ГОСТ 29227.
Горелка газовая.
Баня водяная.
Тигель высокий по ГОСТ 9147.
Бумага фильтровальная по ГОСТ 12026.
Бумага индикаторная для определения рН.
рН-метр любой марки с набором электродов с погрешностью измерения ±0,1 рН.
Свинец азотнокислый по ГОСТ 4236.
Кислота уксусная по ГОСТ 61, раствор концентрации с (![]() )=1,0 моль/дм
)=1,0 моль/дм (1 н.).
Кислота азотная по ГОСТ 4461, раствор концентрации с (![]() )=3,0 моль/дм
)=3,0 моль/дм (3 н.).
Кислота серная по ГОСТ 4204.
Кислота соляная по ГОСТ 3118, раствор концентрации с (НСl)=6,0 моль/дм (6 н.).
Аммиак водный по ГОСТ 3760, раствор концентрации с (![]() )=6 моль/дм
)=6 моль/дм.
Натрий сернистый по ГОСТ 2053.
Глицерин по ГОСТ 6259
6.7.3.2 Подготовка к испытанию
6.7.3.2.1 Приготовление основного раствора свинца
В мерной колбе вместимостью 1000 см растворяют 159,8 мг азотнокислого свинца в 100 см
дистиллированной воды, добавляют 1 см
концентрированной азотной кислоты, перемешивают, доводят объем дистиллированной водой до метки и снова перемешивают. Основной раствор содержит 100 мкг свинца в 1 см
.
Готовят и хранят раствор в стеклянных сосудах, свободных от растворимых солей свинца.
6.7.3.2.2 Приготовление стандартного раствора свинца
В мерную колбу вместимостью 100 см вносят пипеткой 10 см
основного раствора азотнокислого свинца, доливают водой до метки и перемешивают. Стандартный раствор свинца содержит 10 мкг свинца в 1 см
.
Готовят раствор в день проведения испытаний.
6.7.3.2.3 Приготовление раствора сернистого (сульфида) натрия
2,0 г сернистого натрия растворяют в 80 см дистиллированной воды в мерной колбе вместимостью 100 см
, добавляют 2-3 капли глицерина, доводят объем дистиллированной водой до метки и перемешивают.
6.7.3.2.4 Приготовление градуировочных растворов
В колориметрические пробирки вместимостью 25 см вносят пипеткой 0,5; 1; 1,5 и 2 см
стандартного раствора свинца, прибавляют по 10 см
дистиллированной воды, доводят рН раствора уксусной кислотой до рН 3,0-4,0, добавляют дистиллированную воду до объема 20 см
и перемешивают.
Полученные растворы содержат, соответственно: 5; 10; 15 и 20 мкг свинца.
6.7.3.2.5 Подготовка пробы к испытанию
Навеску зубной пасты массой 1,0 переносят в тигель, затем в него добавляют достаточное количество концентрированной серной кислоты для увлажнения вещества.
Тигель тщательно прокаливают на электрической плитке до полного обугливания массы. В период обугливания тигель неплотно прикрывают крышкой.
К обугленной массе добавляют 2,0 см азотной кислоты и 5 капель концентрированной серной кислоты, после чего тигель осторожно нагревают до прекращения выделения белых паров.
Тигель помещают в муфельную печь и прокаливают при 450-500 °С до полного сгорания углерода.
После этого тигель вынимают из муфельной печи, накрывают крышкой, охлаждают, снимают крышку, добавляют 4 см соляной кислоты, ставят для выпаривания на водяную баню на 15 мин и медленно выпаривают досуха.
Остаток увлажняют 1 каплей соляной кислоты, добавляют 10 см дистиллированной воды и водный аммиак по каплям до рН 7,0-7,5 по универсальной индикаторной бумаге.
Полученный раствор фильтруют в пробирку через бумажный фильтр небольшого диаметра, отфильтровывая осадок гидроокисей железа и алюминия. Предварительно фильтр промывают раствором уксусной кислоты, а затем горячей дистиллированной водой.
Тигель и фильтр дополнительно промывают 5 см дистиллированной воды, пропуская ее через тот же фильтр в ту же пробирку.
Раствор в пробирке доводят раствором уксусной кислоты до рН 3,0-4,0, добавляют дистиллированную воду до 20 см и перемешивают.
6.7.3.3 Проведение испытания
В каждую из пробирок для колориметрирования, содержащих испытуемый и градуировочный растворы, вносят по 0,05 см свежеприготовленного раствора сернистого натрия, перемешивают и выдерживают 5 мин.
Сравнивают окраску жидкости в испытуемом растворе с окраской градуировочных растворов.
Оценивают визуально окраску жидкости в каждой пробирке просмотром в проходящем свете по оси пробирок на фоне белой поверхности.
6.7.3.4 Обработка результатов
Если интенсивность окраски испытуемого раствора меньше, чем градуировочного с содержанием свинца 5 мкг, делают вывод, что количество тяжелых металлов в испытуемом образце зубной пасты меньше 5 мкг (0,0005%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 5 мкг, и меньше, чем раствора с 10 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце зубной пасты меньше 10 мкг (0,0010%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 10 мкг, и меньше, чем раствора с 15 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце зубной пасты меньше 15 мкг (0,0015%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 15 мкг, и меньше, чем раствора с 20 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце зубной пасты меньше 20 мкг (0,002%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 20 мкг, делают вывод, что количество тяжелых металлов в испытуемом образце зубной пасты больше 20 мкг (0,002%).
Результаты испытаний соответствуют значениям массовых долей тяжелых металлов в зубных пастах в млн (мг/кг) или %.
6.8 Определение массовой доли фторида
Массовую долю фторида определяют потенциометрически с фторидным электродом: после обработки зубной пасты раствором кислоты по 6.8.1 и 6.8.3 (арбитражный метод), после сплавления зубной пасты с углекислым натрием по 6.8.2, в зубной пасте, содержащей ионизируемые фториды по 6.8.4.
6.8.1 Определение массовой доли фторида после обработки зубной пасты раствором кислоты
Метод заключается в измерении концентрации фторид-иона с помощью фторидного электрода после обработки зубной пасты раствором кислоты.
6.8.1.1 Аппаратура и реактивы
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
рН-метр-милливольтметр-иономер с погрешностью измерения не более 0,25 мВ.
Электрод фторидный типа ЭF-У1.
Электрод стеклянный лабораторный ЭСЛ-43-87.
Электрод сравнения хлорсеребряный ЭВЛ-1М3.
Мешалка магнитная.
Баня водяная.
Колбы 2-100(1000)-2 по ГОСТ 1770.
Колба П-1-100-29/32 ТХС по ГОСТ 25336.
Стакан Н-2-50(1000) ТХС по ГОСТ 25336.
Пипетка 7-10 по ГОСТ 29227.
Сосуды полиэтиленовые вместимостью 100 и 1000 см.
Холодильник воздушный, трубка с конусом КШ 29 по ГОСТ 8682 диаметром 10-15 мм, длиной 100-110 см.
Бумага полулогарифмическая.
Кислота серная по ГОСТ 4204, раствор концентрации (![]() )=0,5 моль/дм
)=0,5 моль/дм (0,5 н.)
Кислота хлорная с массовой долей кислоты 57%, раствор концентрации с (![]() )=0,5 моль/дм
)=0,5 моль/дм (0,5 н.)
Натрий уксуснокислый 3-водный по ГОСТ 199.
Соль динатриевая этилендиамин-N, N, -тетрауксусной кислоты, 2-водная (трилон Б) по ГОСТ 10652.
Кислота уксусная по ГОСТ 61.
Натрий фтористый по ГОСТ 4463, предварительно высушенный до постоянной массы при 105 °С.
Натрий хлористый по ГОСТ 4233.
Натрий лимоннокислый 5,5-водный по ГОСТ 22280.
Натрия гидроокись по ГОСТ 4328, раствор концентрации с (NаОН)=5,0 моль/дм (5 н.).
Вода дистиллированная по ГОСТ 6709.
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не ниже вышеуказанны
6.8.1.2 Подготовка к испытанию
6.8.1.2.1 Приготовление буферного раствора рН 5,0-5,5
В мерную колбу вместимостью 500 см помещают 52,00 г уксуснокислого натрия, 29,20 г хлористого натрия, 3,00 г лимоннокислого натрия, 0,30 г трилона Б и 8 см
уксусной кислоты. Приливают 200-300 см
дистиллированной воды и перемешивают. рН раствора проверяют потенциометрически и, при необходимости, доводят до требуемого значения рН раствором гидроокиси натрия или уксусной кислотой.
Раствор хранят в полиэтиленовом сосуде. Срок хранения 6 мес.
6.8.1.2.2 Приготовление основного градуировочного раствора фтористого натрия концентрацией 0,1 моль/дм
В мерную колбу вместимостью 1000 см помещают 4,1990 г фтористого натрия, растворяют в дистиллированной воде и доводят объем раствора до метки.
Раствор хранят в полиэтиленовом сосуде с плотно закрытой пробкой. Срок хранения 6 мес.
6.8.1.2.3 Приготовление рабочих градуировочных растворов фтористого натрия концентрацией 1·10 до 1·10
моль/дм
.
Для приготовления 1·10 моль/дм
раствора фтористого натрия 10 см
основного градуировочного раствора фтористого натрия концентрацией 0,1 моль/дм
помещают в мерную колбу вместимостью 100 см
, доводят до метки дистиллированной водой и перемешивают.
Градуировочные растворы концентрацией 1·10 моль/дм
и 1·10
моль/дм
готовят аналогично последовательным разбавлением предыдущих растворов.
Все рабочие градуировочные растворы готовят в день построения и проверки градуировочного гр
афика.
6.8.1.2.4 Подготовка к работе фторидного электрода
Новый электрод следует предварительно выдержать в растворе фтористого натрия концентрацией 1·10 моль/дм
в течение суток, затем тщательно промыть дистиллированной водой. Когда работу с электродом проводят ежедневно, его хранят, погрузив в раствор фтористого натрия концентрацией 1·10
моль/дм
. При длительных перерывах в работе электрод хранят в сухом состоянии.
Правильность работы фторидного электрода проверяют при построении градуировочного графика. При измерении потенциалов рабочих градуировочных растворов он должен изменяться от раствора к раствору на (56±3) мВ. Если такая зависимость не соблюдается, то фторидный электрод следует регенерировать вымачиванием в течение суток в растворе фтористого натрия концентрацией 1·10 моль/дм
, затем тщательно отмыть дистиллированной водой.
6.8.1.2.5 Построение градуировочного графика
Для построения градуировочного графика измеряют электродный потенциал каждого приготовленного градуировочного раствора фтористого натрия, начиная с раствора, имеющего наименьшую концентрацию.
В стакан вместимостью 50 см помещают 10 см
градуировочного раствора концентрации 1·10
моль/дм
, 10 см
буферного раствора для устранения мешающего влияния алюминия и железа, магнит от магнитной мешалки, хорошо перемешивают. В раствор погружают фторидный и хлорсеребряный (ЭВЛ) электроды, через 3 мин измеряют значение потенциала. После этого электроды тщательно несколько раз промывают в дистиллированной воде. Далее аналогичным способом измеряют потенциалы электрода в градуировочных растворах концентрацией 1·10
и 1·10
моль/дм
.
При выполнении измерений необходимо следить, чтобы на поверхности мембраны фторидного электрода не налипали пузырьки воздуха.
Все измерения проводят при одинаковой температуре растворов.
На основании полученных результатов строят градуировочный график, откладывая на оси абсцисс с логарифмическими делениями соответствующие концентрации фторид-иона (моль/дм), а на оси ординат значение потенциала в милливольтах (мВ).
Градуировочный график следует проверять каждый раз перед работой по двум-трем градуировочным раствора
6.8.1.3 Проведение испытания
0,5 г зубной пасты взвешивают, результат взвешивания записывают до четвертого десятичного знака, помещают в колбу, приливают 25 см дистиллированной воды и 25 см
0,5 моль/дм
раствора серной или хлорной кислоты.
Соединяют колбу с обратным холодильником и нагревают на кипящей водяной бане в течение 1 ч. После охлаждения до комнатной температуры содержимое количественно переносят в мерную колбу вместимостью 100 см, доводят до метки дистиллированной водой и перемешивают. 10 см
приготовленного раствора помещают в стакан вместимостью 50 см
, приливают 10 см
буферного раствора, перемешивают и через 3 мин измеряют электродный потенциал, как описано в 6.8.1.2.5. Измерив потенциал, по градуировочному графику находят концентрацию фторид-иона в растворе
6.8.1.4 Обработка результатов
Массовую долю фторида %, в пересчете на молярную массу фтора вычисляют по формуле
![]() (3)
(3)
где ![]() - концентрация иона фтора, найденная по градуировочному графику, моль/см
- концентрация иона фтора, найденная по градуировочному графику, моль/см;
19 - молярная масса фтора, г/моль;
100 - вместимость мерной колбы, см;
- масса навески зубной пасты, г.
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,02%, расхождение между результатами измерений в двух лабораториях не должно превышать 0,04%, абсолютная погрешность измерения ±0,02% при вероятности Р=0,95.
6.8.2 Определение массовой доли фторида после сплавления зубной пасты с углекислым натрием
Метод основан на измерении концентрации фторид-иона с помощью фторидного электрода после сплавления зубной пасты с углекислым натрием.
6.8.2.1 Аппаратура и реактивы
Аппаратура и реактивы по 6.8.1.1 со следующим дополнением:
Цилиндр 1-500 по ГОСТ 1770.
Воронка по ГОСТ 25336.
Эксикатор по ГОСТ 25336.
Тигли платиновые с крышками N 6, 7 по ГОСТ 6563.
Печь муфельная, обеспечивающая автоматическое регулирование температуры 750-900 °С.
Фильтр "синяя лента".
Калий углекислый или натрий углекислый по ГОСТ 4332.
Кислота лимонная по ГОСТ 3652.
Кислота соляная по ГОСТ 3118, разбавленная 1:1.
Фенолфталеин, раствор с массовой долей 1%, приготовленный по ГОСТ 4919.1.
Песок кварцевый (при наличии кварцевого стекла или кварцевых трубок их измельчают), допускается применение кремниевой кислоты по ГОСТ 4214, прокаленной при 800-900 °С в течение 1 ч.
6.8.2.2 Подготовка к испытанию
6.8.2.2.1 Приготовление буферного раствора с рН 6,0-6,5
60 г хлористого натрия растворяют в 600 см дистиллированной воды, добавляют 50 см
уксусной кислоты, 21 г лимонной кислоты, 45 г гидроокиси натрия, перемешивают и доводят дистиллированной водой до 1000 см
. Измеряют рН на рН-метре и в случае необходимости прибавляют уксусную кислоту или раствор гидроокиси натрия до требуемого значения рН.
Раствор хранят в полиэтиленовом сосуде. Срок хранения 6 мес.
6.8.2.2.2 Приготовление градуировочных растворов фтористого натрия, подготовку к работе фторидного электрода, построение градуировочного графика проводят по 6.8.1.2.2-6.8.1.2.5.
6.8.2.3 Проведение испытания
0,8-1,0 г зубной пасты взвешивают, результат взвешивания записывают до четвертого десятичного знака, помещают в платиновый тигель, смешивают с 3 г углекислого калия - углекислого натрия. Тигель накрывают крышкой, ставят в муфельную печь при 750 °С, повышают температуру до 870-900 °С и сплавляют при этой температуре в течение 25 мин. Затем тигель вынимают и быстро охлаждают неполным погружением в холодную воду. Плав переносят в стакан и выщелачивают водой при нагревании. После охлаждения содержимое стакана переносят в мерную колбу вместимостью 250 см и доводят водой до метки, перемешивают и фильтруют через фильтр "синяя лента" в коническую колбу, отбрасывая первые порции фильтрата. Отбирают пипеткой 15 см
фильтрата в мерную колбу вместимостью 50 см
, добавляют 1-2 капли раствора фенолфталеина, нейтрализуют малиновую окраску раствором соляной кислоты (1:1), затем раствор в колбе нейтрализуют гидроокисью натрия концентрацией 2 моль/дм
.
К раствору в колбу приливают 25 см буферного раствора, разбавляют водой до метки и перемешивают. Содержимое колбы переносят в стакан, ставят его на магнитную мешалку, опускают электроды, измеряют потенциал и по градуировочному графику находят концентрацию фторид-иона.
6.8.2.4 Обработка результатов
Массовую долю фторида , %, вычисляют по формуле
![]() (4)
(4)
где ![]() - концентрация фторид-иона, найденная по градуировочному графику, моль/см
- концентрация фторид-иона, найденная по градуировочному графику, моль/см;
19 - молярная масса фтора, г/моль; - масса навески зубной пасты, г;
15 - объем раствора, взятого для анализа, см;
250 и 50 - вместимость мерных колб, см.
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,02%, расхождение между результатами измерений в двух лабораториях не должно превышать 0,04%, абсолютная погрешность измерения ±0,02% при вероятности Р=0,95.
6.8.3 Определение массовой доли фторида после обработки зубной пасты хлорной кислотой (арбитражный метод)
Метод основан на измерении концентрации фторид-иона с помощью фторидного электрода в растворе после обработки зубной пасты хлорной кислотой.
6.8.3.1 Аппаратура и реактивы
Центрифуга 10 тыс. об./мин.
рН-метр-милливольтметр-иономер типа рН/ISЕ-metre ORION модель 920А, АНИОН-410 или аналогичный.
Электрод фторидный (простой или комбинированный) ORION модель 9409, 9609, Элит-221 или аналогичный.
Электрод сравнения хлорсеребряный ORION модель 9001, ЭВЛ-1М3 или аналогичный.
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Термостат, обеспечивающий температуру 60 °С.
Баня водяная.
Мешалка магнитная.
Секундомер.
Термометр по ГОСТ 28498, 0-100 °С, цена деления 1 °С.
Колбы 2-100-2, 2-1000-2 по ГОСТ 1770.
Пипетки 4-1-1, 5-1-1, 6-1-5, 6-1-10, 6-1-25; 7-1-5; 7-1-10, 7-1-25 по ГОСТ 29227.
Пипеточные дозаторы по ГОСТ 20790.
Сосуды полиэтиленовые вместимостью 100, 250 и 1000 см.
Стаканы химические мерные В-1-100-ТС вместимостью 50, 100, 150 см по ГОСТ 25336.
Стаканы полиэтиленовые вместимостью 30 см.
Цилиндры 1-25, 3-25 по ГОСТ 1770.
Чашки Петри по ГОСТ 25336.
Кислота лимонная пищевая по ГОСТ 908.
Кислота уксусная ледяная по ГОСТ 61.
Кислота хлорная, раствор массовой долей хлорной кислоты 57%.
Натрий лимоннокислый 5,5-водный по ГОСТ 22280.
Натрий хлористый по ГОСТ 4233.
Натрий фтористый по ГОСТ 4463, предварительно высушенный до постоянной массы при 105 °С.
Натрия гидроокись по ГОСТ 4328, спиртовой раствор концентрации NаОN=0,25 моль/дм (0,25 н.).
Натрия гидроокись по ГОСТ 4328, спиртовой раствор концентрации NаОN=моль/дм (5 н.).
ЦДТА (комплексон IV) - циклогексилендинитрило-тетрауксусная кислота или 1,2-диамин-циклогексан-N, N, N, N-тетрауксусная кислота.
Вода дистиллированная по ГОСТ 6709.
Спирт этиловый ректификованный по ГОСТ 5962.
Допускается применение аппаратуры с метрологическими и техническими характеристиками, а также реактивов по качеству не ниже вышеуказанных.
6.8.3.2 Подготовка к испытанию
6.8.3.2.1 Приготовление буферного раствора, регулирующего общую ионную силу (БРОИС) рН 5,0-5,5.
Помещают в мерный стакан вместимостью 1000 см 58 г хлористого натрия, 57 см
ледяной уксусной кислоты, добавляют 4 г ЦДТА (комплексона IV) или 0,3 г лимоннокислого натрия и 500 см
дистиллированной воды, перемешивают на магнитной мешалке и устанавливают 5 н. раствором гидроокиси натрия рН в пределах 5,0-5,5 (с охлаждением на ледяной бане), добавляют дистиллированную воду до метки.
Раствор хранят в полиэтиленовом сосуде. Срок хранения 12 мес.
6.8.3.2.2 Приготовление основного раствора фтористого натрия концентрацией фторида 1000 мг/дм
В мерную колбу вместимостью 1000 см помещают 2,211 г фтористого натрия, растворяют в дистиллированной воде, доводят объем раствора водой до метки и перемешивают.
Раствор хранят в полиэтиленовом сосуде с плотно закрытой пробкой. Срок хранения 6 мес.
6.8.3.2.3 Приготовление рабочих градуировочных растворов фтористого натрия концентрацией фторида 100 мг/дм, 10 мг/дм
, 1,0 мг/дм
Для приготовления раствора фтористого натрия концентрацией фторида 100 мг/дм 100 см
основного раствора фтористого натрия помещают в мерную колбу вместимостью 1000 см
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 10 мг/дм 100 см
рабочего градуировочного раствора фтористого натрия концентрацией фторида 100 мг/дм
помещают в мерную колбу вместимостью 1000 см
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 1 мг/дм 100 см
рабочего градуировочного раствора фтористого натрия концентрацией фторида 10 мг/дм
помещают в мерную колбу вместимостью 1000 см
, доводят объем дистиллированной водой до метки и перемешивают.
Растворы хранят в холодильнике в полиэтиленовых сосудах с плотно закрытой пробкой. Срок хранени
я 6 мес.
6.8.3.2.4 Приготовление спиртового раствора гидроокиси натрия концентрацией 0,25 моль/дм
10,0 г гидроокиси натрия помещают в мерную колбу вместимостью 1000 см, растворяют в 96%-ном этиловом спирте при постоянном перемешивании на магнитной мешалке. После растворения гидроокиси натрия доводят объем спиртом до метки.
Раствор хранят в полиэтиленовом флаконе с плотно закрытой пробкой. Срок хранения 12 мес.
6.8.3.2.5 Градуировка измерительного устройства
Подготавливают электроды и рН-метр-милливольтметр-иономер в соответствии с инструкцией по эксплуатации прибора.
Градуировка заключается в последовательном измерении отклика иономера (мВ) при погружении фторидного и хлорсеребряного электродов в рабочие растворы фторида концентрацией 1, 10 и 100 мг/дм, предварительно смешанные в объемном соотношении 1:1 с буферным раствором БРОИС.
В ходе измерений растворы постоянно перемешивают на магнитной мешалке. Показания милливольтметра регистрируют через 3 мин после погружения электродов. Перед каждым измерением электроды тщательно промывают дистиллированной водой до постоянного значения потенциала, характерного для отмытого электрода, впитывающей бумагой или тканью осторожно высушивают мембрану фторидного электрода.
Все измерения проводятся при постоянной температуре растворов, равной (25±1) °С.
Крутизна градуировочной (электродной) функции в интервале концентрации фторида 1-10 мг/дм и 10-100 мг/дм
должна составлять 52-60 мВ.
6.8.3.2.6 Подготовка образца зубной пасты для испытания
К навеске зубной пасты 2,50 г приливают 50 см дистиллированной воды и тщательно перемешивают в течение 3 мин на магнитной мешалке. Смесь количественно переносят в мерную колбу вместимостью 100 см
, доводят объем до метки дистиллированной водой и тщательно перемешивают.
В крышку чашки Петри вносят 0,3 см 0,25 н. спиртового раствора гидроокиси натрия и дают возможность спирту испариться на воздухе. В нижнюю часть чашки Петри вносят 2,0 см
смеси из мерной колбы и добавляют 4,0 см
57%-ной хлорной кислоты. Немедленно закрывают чашку Петри крышкой и помещают в термостат при температуре 60 °С на 15-20 ч.
Через 15-20 ч вынимают чашку Петри из термостата и немедленно снимают крышку. Крышку чашки промывают 3-5 раз 2-3 см дистиллированной воды. Промывные воды собирают в отдельную мерную колбу на 25 см
, доводят объем дистиллированной водой до метки и тщательно перемешивают (при этом конечное суммарное разведение составит 1:500).
6.8.3.3 Проведение испытаний
Отбирают 5 см раствора, полученного по 6.8.3.2.6, добавляют 5 см
буферного раствора и через 3 мин после погружения электродов регистрируют показания милливольтметра, как указано в 6.8.3.2.5.
6.8.3.4 Обработка результатов
Концентрацию фторида в пробе , мг/дм
, определяют расчетным путем по уравнению Нернста (по результатам измерения разности потенциалов)
![]() (5)
(5)
где с (1) - концентрация фторида 1 мг/дм;
- разность между показаниями для пробы разведения и рабочего градуировочного раствора концентрацией фторида 1 мг/дм
, мВ;
- крутизна градуировочной (электродной) функции в интервале концентраций фторида 1 и 10 мг/дм
, мВ.
Из трех определений вычисляют среднее арифметическое значение концентрации фторида в пробе (<>).
Массовую долю фторида , мг/кг, вычисляют по формуле
![]() (6)
(6)
где <> - среднее арифметическое значение концентрации фторида, мг/дм
;
- вместимость мерной колбы, равная 0,025 дм
;
- вместимость мерной колбы, равная 0,1 дм
;
- объем пробы, внесенной в чашку Петри, равный 0,002 дм
;
- масса взятой навески, равная 0,0025 кг.
В случае, если измерительный прибор позволяет непосредственно считывать показания в единицах концентрации фторида, вышеуказанное расчетное определение концентрации не проводят.
Массовую долю фторида ,%, в зубной пасте вычисляют по формуле
![]() (7)
(7)
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,02%, относительное расхождение между результатами измерений в двух лабораториях не должно превышать 0,04%, абсолютная погрешность измерения ±0,02% при вероятности Р=0,95.
6.8.4 Определение массовой доли фторида в зубной пасте, содержащей ионизируемые фториды
Метод заключается в измерении концентрации иона фтора с помощью фторидного электрода в зубных пастах, содержащих соединения фторида, образующие в водной среде свободные ионы фтора.
6.8.4.1 Аппаратура и реактивы по 6.8.1.1.
6.8.4.2 Подготовка к испытанию по 6.8.1.2.
6.8.4.3 Проведение испытания
От 1,0 до 2,0 г зубной пасты взвешивают в стакан вместимостью 100 см, результат взвешивания записывают до четвертого десятичного знака, приливают 60 см
дистиллированной воды и интенсивно перемешивают на магнитной мешалке 10 мин. Содержимое стакана количественно переносят в мерную колбу вместимостью 100 см
, доводят объем дистиллированной водой до метки, перемешивают и оставляют для осаждения на 5 ч или центрифугируют 10 мин.
От 5 до 10 смполученного прозрачного раствора помещают в стакан вместимостью от 30 до 50 см
, добавляют равный объем буферного раствора и перемешивают на магнитной мешалке. Показания милливольтметра регистрируют через 3 мин после погружения электродов.
6.8.4.4 Обработка результатов
Концентрацию фторида в пробе определяют по 6.8.3.4, формула (5).
Массовую долю фторида , мг/кг, вычисляют по формуле
![]() (8)
(8)
где - средняя концентрация фторида в испытуемой надосадочной жидкости, мг/дм
;
- вместимость мерной колбы=0,1 дм
;
- масса взятой навески СГПР, кг.
Массовую долю фторида , %, в СГПР вычисляют по формуле
![]() (9)
(9)
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,02%, относительное расхождение между результатами измерений в двух лабораториях не должно превышать 0,04%, абсолютная погрешность измерения ±0,02% при вероятности Р=0,95.
6.9 Определение массы фторида в единице упаковки
Массу фторида в единице упаковки вычисляют на основании массовой доли фторида, найденной по 6.8.1, 6.8.2, 6.8.3, 6.8.4.
Массу фторида в единице упаковки вычисляют по формуле
![]() (10)
(10)
где - масса зубной пасты в единице упаковки, кг;
- массовая доля фторида, найденная по 6.8.1, 6.8.2, 6.8.3, 6.8.4.
6.10 Определение абразивности
Абразивность определяют по приложению В.
6.11 Клинические и токсикологические испытания
Клинические и токсикологические испытания проводят в соответствии с методами, утвержденными органами Минздрава РФ.
7 Транспортирование и хранение
7.1 Зубные пасты транспортируют всеми видами транспорта в крытых транспортных средствах, обеспечивающих сохранность продукции, в соответствии с правилами перевозки грузов, действующими на транспорте данного вида.
7.2 Зубные пасты хранят при температуре не ниже 0 °С и не выше 25 °С в крытых складских помещениях.
Не допускается хранить пасты под непосредственным воздействием солнечного света и вблизи отопительных приборов.
8 Гарантии изготовителя
8.1 Предприятие-изготовитель гарантирует соответствие зубных паст требованиям настоящего стандарта при соблюдении условий транспортирования и хранения.
8.2 Срок годности для каждого конкретного наименования зубной пасты устанавливает предприятие-изготовитель.
ПРИЛОЖЕНИЕ А (справочное). Схема выделения и идентификации микроорганизмов из зубной пасты
ПРИЛОЖЕНИЕ А
(справочное)
Рисунок А.1
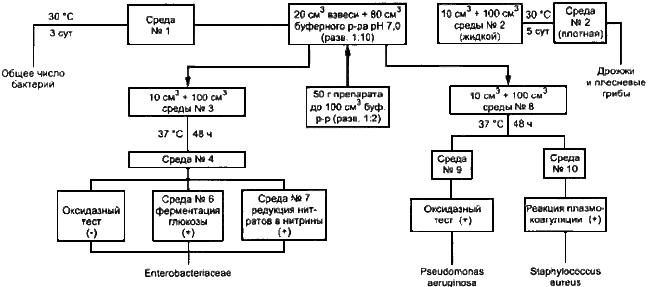
Рисунок А.1
ПРИЛОЖЕНИЕ Б (рекомендуемое). Определение общего фторида в средствах для чистки зубов
ПРИЛОЖЕНИЕ Б
(рекомендуемое)
Международный стандарт ИСО 11609-95.
Определение общего фторида в средствах для чистки зубов
Б.1 Область применения
В настоящем приложении описывается ряд различных методов анализа фторидсодержащих средств для чистки зубов на общее содержание фтористых соединений.
Б.2 Методы
Б.2.1 Общее содержание фтористых соединений в средстве для чистки зубов (пасте и геле): метод Американской стоматологической ассоциации (АСА)
Б.2.1.1 Сущность метода
В данном методе реализуется диффузионный метод, позволяющий экстрагировать фтористое соединение в виде НF (фтористого водорода) из основы средства для чистки зубов, а затем измерять общее содержание фтористого соединения с использованием ионоизбирательного электрода. Приготовление пробы планируется таким образом, чтобы учитывалось присутствие фтористого кальция и/или фтористого соединения, связанного диоксидом кремния, в средствах для чистки зубов с использованием этилендиаминтетрауксусной кислоты (ЭДТА).
Б.2.1.2 Методика
Покрыть внутреннюю поверхность полистироловых крышек чашек Петри (60х15 мм) спиртовым раствором гидроокиси натрия концентрацией 0,5 моль/дм в количестве 0,3 см
и дать возможность спирту испариться.
Взвесить приблизительно 1 г пасты. Применяя степень разбавления 1:10, добавить 10 смраствора (ЭДТА) концентрацией 0,1 моль/см
и с водородным показателем рН, заранее скорректированным до 8,0 путем добавления по мере необходимости NаОН. Гомогенизировать смесь в течение 1 мин и центрифугировать 4 см
суспензии при 14000 об/мин в течение 5 мин, пользуясь для этого центрифугой "Эппендорф 5451"*. Перенести 2 см
отстоявшегося слоя жидкости на дно чашки Петри. Добавить 4 см
70%-ного раствора
![]() и немедленно накрыть крышкой, покрытой спиртовым раствором гидроокиси натрия.
и немедленно накрыть крышкой, покрытой спиртовым раствором гидроокиси натрия.
____________
* Данная информация дается для удобства пользователей настоящего международного стандарта и не является поддержкой для названного изделия со стороны ИСО.
ПРЕДОСТЕРЕЖЕНИЕ - Эта последняя операция должна выполняться с исключительной аккуратностью, чтобы пена, образующаяся после добавления ![]() , не увлажнила крышку.
, не увлажнила крышку.
Поместить чашку Петри в сушильный шкаф и выдерживать там при 60 °С в течение не менее 6 ч.
Извлечь чашки Петри из сушильного шкафа и дать им возможность охладиться до комнатной температуры. Снять крышку и промыть дважды 5 см деионизированной воды, получая в результате общий объем раствора, равный 10 см
. Перенести 1 см
данного раствора в пластиковый химический стакан вместимостью от 3 до 5 см
и добавить 1 см
буферного раствора, регулирующего общую ионную силу раствора, TISAB 11. Подвергнуть раствор анализу на фтористые соединения, пользуясь ионоизбирательным электродом. Построить по пяти точкам калибровочную кривую и использовать ее для определения содержания фтористых соединений в каждой из суспензий средства для чистки зубов.
Б.2.2 Общее содержание фтористых соединений в средстве для чистки зубов
Примечание - Данный метод основывается на Индийском стандарте IS 6356.
Б.2.2.1 Принцип
Ионы монофторфосфата или фторида натрия экстрагируются водой из зубной пасты, и экстракт расплавляется вместе с карбонатом натрия с целью его превращения во фторид натрия. Затем потенциометрическим путем при помощи электрода, чувствительного к ионам фтористых соединений, определяется содержание фтористых соединений.
Б.2.2.2 Аппаратура
Б.2.2.2.1 рН-метр (потенциометр).
Б.2.2.2.2 Электрод, чувствительный к ионам фтористых соединений.
Б.2.2.2.3 Насыщенный каломельный электрод в качестве эталонного электрода.
Б.2.2.3 Реактивы
Б.2.2.3.1 Фторид натрия, реактивная чистота.
Б.2.2.3.2 Триэтаноламин чистый.
Б.2.2.3.3 ЭДТА, соль динатрия, дигидрат, реактивная чистота.
Б.2.2.3.4 Карбонат натрия, реактивная чистота.
Б.2.2.3.5 Хлористоводородная (соляная) кислота, реактивная чистота.
Б.2.2.4 Стандартные (титрованные) растворы и растворы реактивов
Б.2.2.4.1 Буферный раствор триэтаноламина.
Растворить 149 г чистого триэтаноламина в 600 см дистиллированной воды и при помощи концентрированной хлористоводородной кислоты провести коррекцию водородного показателя рН до 7,0, пользуясь при этом рН-метром. Охладить раствор до комнатной температуры и определить рН; при необходимости провести его повторную коррекцию; затем развести до 1000 см
дистиллированной водой.
Б.2.2.4.2 ЭДТА, раствор концентрацией 0,1 моль/дм
Взвесить точно 37,224 г ЭДТА и растворить ее в дистиллированной воде; довести объем раствора до 1000 см в мерной колбе.
Б.2.2.4.3 Стандартный раствор фторида натрия (0,1 мг F на см)
Просушить фторид натрия при 110 °С в течение 4 ч и перенести точно 0,222 г в мерную колбу вместимостью 100 см. Добавлять дистиллированную воду с целью разведения фторида натрия и дополнить объем до риски (раствор А). Взять 10 см
данного раствора А, поместить в мерную колбу вместимостью 1000 см
и дополнить данный объем до риски (раствор В). 1 см
раствора В содержит 0,01 мг ионов фторида. Поместить растворы А и В на хранение в полиэтиленовые бутыли.
Б.2.2.5 Приготовление стандартных растворов фторида натрия
Поместить 1, 2, 5, 10, 20 и 25 см раствора В (В.2.2.4.3) в мерные колбы вместимостью 100 см
, промаркированные буквами А, В, С, D, Е и F соответственно. В каждую из них добавить 25 см
ЭДТА и 10 см
буферного раствора гидрохлорида триэтаноламина и дополнить объем до 100 см
дистиллированной водой. Теперь растворы А, В, С, D, Е и F содержат 0,01, 0,02, 0,05, 0,1, 0,2 и 0,25 мг ионов фторида на 100 см
соответственно. Налить растворы в полиэтиленовые химические стаканы вместимостью 150 см
для измерения разности потенциалов.
Б.2.2.6 Исследуемый раствор
Взвесить точно 5,0 г зубной пасты в химическом стакане вместимостью 150 см и добавить 50 см
дистиллированной воды. Перемешать при помощи магнитной мешалки при температуре около 40 °С в течение 30 мин и охладить. Центрифугировать раствор в течение 10 мин при 15000 об/мин, промыть и собрать промывочную воду. Поместить отстоявшуюся жидкость и промывочную воду в мерную колбу вместимостью 100 см
и довести до риски. Перелить раствор в полиэтиленовую бутыль. Поместить 5 см
этого раствора отстоявшейся воды в платиновый тигель вместимостью 25 см
и добавить 1 см
10 %-ного (по объему) раствора карбоната натрия. Нагреть тигель над пламенем до высушивания. Перенести тигель в муфельную печь и нагревать до 600 °С. После охлаждения тигля в эксикаторе добавить 25 см
ЭДТА концентрацией 0,1 моль/дм
и прокипятить в течение некоторого времени. Охладить и переместить в мерную колбу вместимостью 100 см
(при необходимости произвести фильтрацию раствора). Добавить 10 см
буферного раствора гидрохлорида триэтаноламина и дополнить объем до 100 см
. Перелить раствор в полиэтиленовый химический стакан вместимостью 150 см
для измерения разности потенциалов. Размешать стандартные растворы и исследуемые растворы с помощью магнитной мешалки и измерить устойчивую разность потенциалов в милливольтах. Показания по стандартным и исследуемым растворам следует снимать одновременно.
Б.2.2.7 Расчет
На полулогарифмической бумаге строится график зависимости содержания ионов фторида от разности потенциалов. Разность потенциалов в милливольтах откладывается по оси X, а содержание ионов фторида в миллиграммах по оси У (по логарифмической шкале).
По калибровочной кривой определить концентрации, с, фтористых соединений в зубной пасте, млн (мг/кг), в исследуемых растворах, а именно:
![]() (Б.1)
(Б.1)
где - содержание ионов фторида, мг, найденное из калибровочного графика;
- масса пробы, г.
ПРИЛОЖЕНИЕ В (обязательное). Определение абразивности (по Хефферену)
ПРИЛОЖЕНИЕ В
(обязательное)
Международный стандарт ИСО 11609-95.
Определение абразивности (по Хефферену)
B.1 Область распространения
В настоящем положении устанавливаются конкретные процедуры определения абразивности средств чистки зубов с использованием лабораторного метода Американской стоматологической ассоциации (АСА).
В.2 Отбор проб
Представительная выборка должна быть взята не менее чем из двух партий.
В.3 Процедура
В.3.1 Типовой эталонный абразив
Типовой эталонный абразив берется из специальной партии пирофосфата кальция, держателем которого является фирма "Монсанто Кампани".*
___________
* Пирофосфат кальция представляет собой пример подходящего продукта, имеющегося в продаже. Данная информация дается для удобства пользователей настоящего международного стандарта и не является поддержкой для данного продукта со стороны ИСО. Образец материала можно получить, связавшись с компанией по указанному ниже адресу и сделав заявку на эталон стираемости Американской стоматологической ассоциации (АСА). При сопоставлении партий были отмечены незначительные отклонения (<10%) в абразивности.
В.3.2 Установка
В.3.2.1 Щеточная машина
Перекрестно-щеточная машина является избранным аппаратом*. Аппарат должен иметь восемь позиций для размещения образцов. Зубная щетка должна устанавливаться таким образом, чтобы совершать возвратно-поступательное движение по закрепленным образцам с заданным давлением на щетке при погружении в суспензию для чистки зубов. Расстояние, проходимое щеткой, не должно превышать длину головки щетки, для того чтобы образец постоянно находился в контакте со щеткой. Механизм удержания емкости с суспензией для чистки зубов может быть различным в зависимости от конструкции машины, но он должен обеспечивать возможность легкого извлечения пробы суспензии. Важно располагать механизмом для перемешивания суспензии в то время, когда происходит чистка. Удобным способом осуществления этого является прикрепление резиновых перемешивающих лопаток непосредственно под головкой щетки. Пока осуществляется процесс чистки, данные лопатки будут препятствовать оседанию абразива на дно емкости с суспензией.
___________
* Схемы и светокопии чертежей машины можно получить в Американской стоматологической ассоциации
Monsanto Company,
Detergent Division,
800 N. Lindbergh Boulevard,
St. Louis, МО,
USA 63167.
В.3.2.2. Детектор радиоактивности
Рекомендуются два метода определения радиоактивности используемых суспензий для чистки зубов с применением планшетного счетчика Гейгера-Мюллера или жидкостного сцинтилляционного детектора. Применение счетчика Гейгера-Мюллера требует, чтобы пробы были просушены при определенных регулируемых условиях. Метод использования жидкого сцинтиллятора обладает преимуществом, заключающимся в том, что показания можно считывать непосредственно, имея в распоряжении суспензию.
Счет должны проводить в течение периода времени, ожидаемого для уменьшения числа альфа-частиц, с тем чтобы свести погрешность счета до значения менее 2%. Счет должны осуществлять на протяжении, как минимум 1000 одиночных импульсов и в течение не менее 1 мин. Число ходов щетки при чистке может быть увеличено, если периоды времени счета импульсов становятся слишком длительными.
В.3.3 Представление зубных образцов
В.3.3.1 Образцы дентина
В.3.3.1.1 Отбор
В качестве субстрата используется корневой дентин удаленных постоянных зубов человека. Следует отбирать однокорневые зубы, бывшие при удалении витальными. Исключение, в виду малых размеров, составляют нижнечелюстные резцы, от их использования следует отказаться. Образец должен иметь длину не менее 14 мм и ширину не менее 2 мм в узкой части. Все корни не должны быть поражены кариесом и должны быть лишены анатомических недостатков. После удаления корни должны храниться в нейтрализованном 4%-ном растворе формальдегида.
В.3.3.1.2 Подготовка
Начисто соскоблить с корней все мягкие ткани и корешковую кору (цементное вещество зубов). Затем удалить коронку и корневые верхушки, пользуясь сепарационным зубным диском под струей воды.
В.3.3.1.3 Облучение
К каждому комплекту, состоящему из восьми образцов, подлежащих облучению, добавить один или два дополнительных корня с целью их использования при расчете поправочных коэффициентов. Законсервировать образцы в 4%-ном растворе формальдегида и подвергнуть воздействию ядерного реактора с целью облучения. Нейтронный поток должен быть достаточным для того, чтобы достигнуть интенсивности бета-излучения изотопа , составляющей около 1 мКи, по истечении нескольких часов. Необходимо избегать повышенных температур в реакторе. Желательно также экранировать пробы от потока быстрых нейтронов и гамма-излучения.
Обращаться с облученными образцами необходимо с осторожностью, пользуясь надежными лабораторными методиками. Образцы не должны использовать в течение первого периода полураспада вследствие избыточного излучения, использовать их необходимо перед окончанием третьего периода полураспада из-за потери на данной стадии радиоактивности. Период полураспада изотопа составляет 14,3 дня, таким образом интервал использования комплекта зубов равен четырем неделям.
В.3.3.1.4 Монтаж образцов
Образцы необходимо монтировать по отдельности в зубопротезном метилметакрилате, отверждающемся (твердеющем) в естественных условиях, тип используемой формы будет зависеть от держателя на щеточной машине. Образцы должны монтировать таким образом, чтобы они выступали над поверхностью зубопротезной пластмассы при щечной/язычной ориентации не менее чем на 2 мм. Поверхность корня, подлежащая очистке, должна быть при щечной/язычной ориентации параллельна пластмассодержателю и должна располагаться таким образом, чтобы процесс чистки осуществлялся в направлении, перпендикулярном большему размеру корня. Смонтированные образцы должны хранить в 4%-ном растворе формальдегида.
В.3.3.2 Образцы зубной эмали
В.3.3.2.1 Отбор
Критерии для отбора образцов зубной эмали те же, что и для дентина. Образцы зубной эмали следует брать с верхнечелюстных резцов человека.
В.3.3.2.2 Подготовка
После удаления корня используется вся губная поверхность образца. Очистку зубной эмали следует производить тем же способом, что и в случае с корнем.
В.3.3.2.3 Облучение
Метод облучения зубной эмали идентичен методу, используемому для облучения корней. Корни и образцы зубной эмали можно консервировать вместе, с тем чтобы подвергнуть воздействию реактора с целью облучения.
В.3.3.2.4 Монтаж
Монтаж (установку) образцов зубной эмали следует производить тем же способом, что и в случае корней. Губная поверхность должна выступать на 2 мм и быть параллельной поверхности зубопротезной пластмассы.
В.3.4 Зубные щетки
Используемые зубные щетки должны иметь нейлоновые щетинки средней жесткости. Концы щетинок должны лежать скорее в одной плоскости, чем иметь форму пилообразной или пучкообразной конструкции с приподнятыми концами. 50-пучковая среднетекстурная зубная щетка "Пепсодент" удовлетворяет критериям годности и имеется в продаже*.
___________
* Данная информация дается для удобства пользователей настоящего международного стандарта и не является поддержкой для названного изделия со стороны ИСО.
Зубные щетки с вечера поместить в воду перед их первым употреблением и затем держать в воде до тех пор, пока они не выйдут из употребления. Для каждого комплекта зубов использовать новый комплект зубных щеток. Не вынимать щетки из машины между рабочими циклами, а отводить пучки от образца нужно таким образом, чтобы не сгибать щетинки. В начале каждого цикла используя пружинный манометр Шатильона или эквивалентное ему устройство установить давление щетки на образец до 150 г. Это давление должно перепроверяться, по крайней мере, дважды в день. Метод настройки давления будет меняться в зависимости от типа механизма на щеточной машине.
В.3.5 Эталонный разбавитель
Разбавителем является 0,5%-ный раствор карбоксиметилцеллюлозы (CMC) (7MF) в 10%-ном глицерине. Чтобы приготовить 1 дм разбавителя, следует нагреть 50 см
глицерина до 60 °С и добавить, перемешивая, 5 г CMC. После того, как смесь станет гомогенной, добавить еще 50 см
подогретого глицерина и непрерывно перемешивать смесь в течение 60 мин. Перелить раствор в сосуд емкостью 1 дм
, добавить 900 см
дистиллированной воды. Дать возможность охладиться, но при этом продолжать медленное помешивание в течение всей ночи. Стабилизировать вязкость, перед использованием дать раствору возможность выдержаться на протяжении ночи. Данный раствор используется для составления суспензий эталонного абразива или любого испытуемого порошка.
В.3.6 Суспензия эталонного абразива
Эталонным материалом является материал, описанный выше (В.3.1). Развести 10 г абразива 50 см разбавителя (В.3.5). Для всех порошков используется одно и то же соотношение. Для эталонного абразива существует возможность его использования в качестве средства для чистки зубов. Если предполагается это сделать, то оно должно быть составлено как 40% абразивного средства для чистки зубов с остальными составляющими, представляющими собой традиционные компоненты средств для чистки зубов. После этого готовится суспензия из 25 г эталонного средства для чистки зубов и 40 см
воды.
В.3.7 Суспензии средств для чистки зубов
Для того чтобы приготовить испытательные суспензии, добавить 40 см воды к 25 г каждого средства для чистки зубов. Для машины приготовить восемь суспензий каждого средства для чистки зубов. В результате данного разбавления получаются окончательные объем и концентрация суспензии, аналогичные тем, которые получены для суспензии эталонного абразива. Все суспензии (эталонные и испытательные) должны быть использованы вскоре после приготовления и энергичного механического перемешивания с целью предотвращения оседания частиц.
В.3.8 Предварительная обработка зубных образцов
В.3.8.1 Дентин
Чтобы уменьшить колебание, обусловленное поверхностными различиями дентина, образцы перед каждым использованием предварительно обрабатывают. Предварительная обработка состоит в чистке щеткой с использованием суспензии эталонного абразива, но взятой не из пробы. Когда образцы дентина используют в первый раз, предварительная обработка должна осуществляться в течение 6000 ходов. Каждый последующий ежедневный цикл должен начинаться с более короткой предварительной чистки, состоящей из 1000 ходов. Давление зубной щетки на корни должно составлять 150 г.
Суспензии, использованные для предварительной обработки, далее не используют.
В.3.8.2 Зубная эмаль
Предварительная обработка зубной эмали аналогична той, которую осуществляют для дентина, за исключением того, что перед первым использованием образцов выполняется 10000, а в начале каждого дня - 1000 ходов.
Суспензии, использованные для предварительной обработки, далее не используют.
В.3.9 План проведения испытания
В.3.9.1 План проведения испытания применительно к дентину
План испытания может быть построен либо по принципу "сэндвича" (чередования), либо по принципу латинского квадрата. План по принципу "сэндвича" заключается в том, что в опыте участвует комплект эталонных суспензий (предыспытательная стадия), после чего в опыт вступает комплект первых испытательных суспензий. Затем за ними следует второй комплект эталонных суспензий (послеиспытательная стадия). Данный второй комплект эталонных суспензий впоследствии выступает в качестве предыспытательных суспензий для следующей испытательной группы. Это продолжается до тех пор, пока в опыт не будут введены все испытательные группы.
План по принципу латинского квадрата заключается в том, что первым в опыт вступает комплект эталонных суспензий. Все испытательные группы рандомизируются (распределяются по случайному принципу) по восьми чистящим головкам для следующих нескольких циклов (в зависимости от числа испытательных групп). Затем в качестве заключительной процедуры в опыт вводится послеиспытательный комплект эталонных суспензий.
В обоих планах испытания давление щетки устанавливается около 150 г, и чистка осуществляется в течение периода времени, охватывающего от 1500 до 3000 ходов, в зависимости от уровня радиоактивности образцов.
В.3.9.2 План проведения испытания применительно к зубной эмали
План испытания для зубной эмали идентичен тому, который составлен для дентина, за исключением того, что число ходов составляет от 5000 до 7500, в зависимости от радиоактивности образцов.
В.3.10 Отбор проб суспензий
Взятие проб суспензий после чистки одинаково как для дентина, так и для зубной эмали. Аликвотная проба каждой суспензии берется срезу же после чистки. Размер аликвотной пробы будет зависеть от метода счета и оборудования, 3 см достаточно для того, чтобы обеспечить поддающийся выявлению уровень радиоактивности. Подходящим методом для взятия пробы является применение шприца, снабженного тупоконечной иглой. Следует соблюдать аккуратность, чтобы гарантировать отсутствие какого бы ни было переноса радиоактивности с одной пробы на другую. Наилучшим способом для этого является полное промывание шприца в промежутках между взятием проб. Важно также отбирать одно и то же количество пробы от каждой из суспензий. Пробу следует просушить, если для выявления радиоактивности используется планшетная система счета. В том случае, если требуется высушивание, пробы должны подвергаться воздушной сушке в течение не менее 1 ч, а затем просушиваться в сушильном шкафу при 60 °С с нагнетанием воздуха в течение всей ночи.
В.3.11 Поправочные коэффициенты
Поправочные коэффициенты необходимы при испытаниях на стираемость как дентина, так и зубной эмали, в том случае, когда используется планшетный метод счета и когда они одинаково приготовлены для испытания. При испытаниях средств для чистки зубов с абразивными системами, отличными от эталонного материала, характеристики самопоглощения и обратного (отраженного) рассеяния абразивов для бета-излучения также могут различаться. В таком случае действительные различия в абразивности могут быть в значительной степени искажены. Поправочный коэффициент представляет собой средство снижения влияния данной переменной. Поправочный коэффициент определяется по-разному, в зависимости от используемого метода счета.
В.3.11.1 Приготовление суспензий для определения поправочных коэффициентов в случае планшетного метода счета по Гейгеру-Мюллеру
Растворить одну часть облученного дентина (или зубной эмали) в 5 см концентрированной соляной кислоты НСl. Перелить раствор в мерную колбу емкостью 250 см
и добавить воду до риски. Добавить 1,0 см
данного радиоактивного раствора в суспензии эталонного абразива и в каждый из испытательных абразивов, которые готовят тем же способом, что и при проведении испытания. Нейтрализовать кислоту, добавляя 1,0 см
NаОН, концентрацией 0,5 моль/дм
. Тщательно перемешать суспензии, взять пробы и просушить их вместе с пробами, отобранными для испытательных циклов. Не следует использовать данные суспензии, предназначенные для определения поправочных коэффициентов, для чистки щеткой.
Данные пробы считаются вместе с испытательными пробами.
В.3.11.2 Расчет поправочных коэффициентов
Поправочный коэффициент , который должен применяться ко всем числам отсчетов, полученным для испытательной пробы, рассчитывается следующим образом:
![]() (В.1)
(В.1)
В.3.11.2.1 Поправочные коэффициенты для счета жидкостным сцинтилляционным методом
Поправка относится к количеству пробы, смешанной со сцинтилляционным коктейлем (смесью). Каждая проба взвешивается, и суммарный (результирующий) отсчет в минуту (СРМ - count per minute) делится на массу, в результате чего получается суммарный СРМ на грамм суспензии. Данные значения суммарного СРМ на грамм впоследствии используются при расчете абразивности вместо значений суммарного СРМ в В.3.12, и термин как таковой отсутствует.
В.3.11.2.2 Поправочные коэффициенты для обнаружения жидкостным сцинтилляционным методом
Поскольку в качестве среды используется жидкость, самопоглощение и обратное рассеяние представляют меньший интерес. Наиболее современное жидкостное сцинтилляционное оборудование обеспечит хроматическую коррекцию автоматически, так что с этим проблем нет. Разности в массах проб необходимо учитывать при расчете. Чтобы обеспечить это, каждая проба, взятая после процесса щеточной чистки, должна быть взвешена с точностью до 0,01 г.
В.3.11.2.3 Применение поправочного коэффициента
Прежде чем приступить к расчету значений относительной стираемости, суммарный СРМ каждой суспензии следует разделить на массу используемой суспензии и получить в результате этого суммарный СРМ на грамм суспензии. Эти значения впоследствии используются при расчете значений относительной стираемости.
В.3.12 Расчет абразивности с использованием счета по Гейгеру-Миллеру
В.3.12.1 Абразивность для дентина
Абразивность испытуемых средств для чистки зубов (или абразивов) для дентина рассчитывается следующим образом:
|
| Суммарный СРМ перед испытанием + |
|
| |||
2 | |||||||
|
|
|
|
| |||
Средний эталонный суммарный СРМ | |||||||
В.3.12.2 Абразивность для зубной эмали
Абразивность испытуемых средств для чистки зубов (или абразивов) для зубной эмали рассчитывается следующим образом:
|
| Суммарный СРМ перед испытанием + |
|
| |||
2 | |||||||
|
|
|
|
| |||
Средний эталонный суммарный СРМ | |||||||
В.3.13 Расчет абразивности с использованием жидкостной сцинтилляции
В.3.13.1 Абразивность для дентина
Абразивность испытуемых средств для чистки зубов (или абразивов) для дентина рассчитывается следующим образом:
|
| Суммарный СРМ на грамм перед испытанием+ 2 |
|
| |||
Абразивность средства для чистки зубов |
| 100хсуммарный СРМ на грамм испытуемого средства для чистки зубов |
|
| |||
Средний эталонный суммарный СРМ на грамм | |||||||
В.3.13.2 Абразивность для зубной эмали
Абразивность испытуемых средств для чистки зубов (или абразивов) для зубной эмали рассчитывается следующим образом:
Средний эталонный суммарный СРМ на грамм |
| Суммарный СРМ на грамм перед испытанием + |
|
| |||
2 | |||||||
|
| 10хсуммарный СРМ на грамм |
|
| |||
Средний эталонный суммарный СРМ | |||||||
ПРИЛОЖЕНИЕ Г (справочное). Библиография
ПРИЛОЖЕНИЕ Г
(справочное)
[1] ВФС 42-1801-88 Питательная среда N 1 для контроля микробной загрязненности, сухая
[2] ВФС 42-1802-88 Питательная среда N 2 для контроля микробной загрязненности, сухая (Сабуро)
[3] ВФС 42-1803-88 Питательная среда N 3 для контроля микробной загрязненности, сухая
[4] ФС 42-186ВС-88 Питательная среда N 4 для выделения энтеробактерий, сухая (Агар Эндо)
[5] ВФС 42-2038-91 Питательная среда N 6 для контроля микробной загрязненности, сухая
[6] ВФС 42-2020-90 Питательная среда N 7 для контроля микробной загрязненности, сухая
[7] ФС 42-3181-95 Питательная среда N 8 для контроля микробной загрязненности, сухая
[8] ВФС 42-1908-89 Питательная среда N 9 для контроля микробной загрязненности, сухая
[9] ВФС 42-1909-89 Питательная среда N 10 для контроля микробной загрязненности, сухая