ГОСТ 13056.5-76*
Группа С99
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Семена деревьев и кустарников
МЕТОДЫ ФИТОПАТОЛОГИЧЕСКОГО АНАЛИЗА
Seed of trees and shrubs. Methods of phytopathological analysis
ОКСТУ 9709
Дата введения 1977-07-01
Постановлением Государственного комитета стандартов Совета Министров СССР от 11 мая 1976 г. N 1159 срок введения установлен с 01.07.77
Проверен в 1986 г. Постановлением Госстандарта от 17.12.86 N 3895 срок действия продлен до 01.07.92**
________________
** Ограничение срока действия снято постановлением Госстандарта СССР от 17.01.92 N 31 (ИУС N 5, 1992 год). - Примечание изготовителя базы данных.
ВЗАМЕН ГОСТ 13056.5-67
* ПЕРЕИЗДАНИЕ (октябрь 1987 г.) с Изменением N 1, утвержденным в декабре 1986 г. (ИУС 3-87).
Настоящий стандарт распространяется на семена деревьев и кустарников, предназначенные для посева, и устанавливает следующие методы фитопатологического анализа: биологический, макроскопический и центрифугирования.
1. БИОЛОГИЧЕСКИЙ МЕТОД
1. БИОЛОГИЧЕСКИЙ МЕТОД
1.1. Биологический метод предназначен для установления внешней и внутренней зараженности семян на питательной среде или во влажной камере.
1.1.1. Внутреннюю зараженность определяют у семян абрикоса, вишни, дуба, миндаля, ореха, персика, сливы, черешни, черемухи. Внешнюю зараженность определяют у семян всех других видов.
1.1; 1.1.1. (Измененная редакция, Изм. N 1).
1.1.2. Во влажной камере определяют зараженность семян всех видов вишни, ильмовых, клена, миндаля, персика, сливы, черешни, черемухи, ясеня.
На питательных средах определяют зараженность всех других видов.
(Введен дополнительно, Изм. N 1).
1.2. Отбор проб
1.2.1. Перед отбором семян лотки, шпатели и совочки протирают спиртом, а бюксы и бумажные пакеты стерилизуют в течение 1 ч при температуре 130 °С в сушильном шкафу.
1.2.2. Для определения внешней зараженности из разных мест среднего образца, составленного по ГОСТ 13056.1-67, отбирают: не менее 200 семян бука, каштана, лещины, фисташки, кедрового стланика, сосны корейской, сосны кедровой сибирской, из них на анализ выделяют по 100 семян; и не менее 500 семян всех других видов, из них на анализ выделяют по 200 семян.
1.2.3. Для определения внутренней зараженности из разных мест среднего образца по ГОСТ 13056.1-67 отбирают не менее 200 семян. Из них выделяют 100 семян.
1.2.2; 1.2.3. (Измененная редакция, Изм. N 1).
1.2.4. Остатки семян, выделенных из среднего образца, хранят в течение 1 месяца на случай повторения анализа.
1.3. Аппаратура, материалы и реактивы
1.3.1. Для проведения анализа применяют:
автоклав;
весы технические;
лампы бактерицидные;
микроскоп;
термостаты суховоздушные;
шкаф сушильный;
счетчик-раскладчик;
спиртовку;
бокс;
лотки;
шпатели;
совочки;
бюксы почвенные;
колбы плоскодонные немерные вместимостью 500 и 1000 мл по ГОСТ 25336-82;
респираторы по ГОСТ 17269-71;
чашки Петри по ГОСТ 25336-82;
пинцеты;
скальпели;
воронки стеклянные по ГОСТ 25336-82;
стекла предметные по ГОСТ 9284-75;
стекла покровные по ГОСТ 6672-75;
пипетки по ГОСТ 20292-74*;
________________
* На территории Российской Федерации документ не действует. Действуют ГОСТ 29169-91, ГОСТ 29227-91 - ГОСТ 29229-91, ГОСТ 29251-91 - ГОСТ 29253-91. - Примечание изготовителя базы данных.
крафт-бумагу;
бумагу фильтровальную по ГОСТ 12026-76;
вату по ГОСТ 5556-81;
мешочки марлевые;
калий марганцевокислый по ГОСТ 20490-75;
спирт этиловый ректификованный по ГОСТ 5962-67*;
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 51652-2000. - Примечание изготовителя базы данных.
спирт этиловый питьевой 95%-ный по ГОСТ 5963-67*;
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 51723-2001. - Примечание изготовителя базы данных.
спирт этиловый технический по ГОСТ 17299-78;
воду стерилизованную или свежекипяченую;
агар-агар по ГОСТ 17206-84* или ГОСТ 16280-70*;
________________
* На территории Российской Федерации документы не действует. Действуют ГОСТ 17206-96 и ГОСТ 16280-2002, соответственно. - Примечание изготовителя базы данных.
кислоту лимонную 50%-ную по ГОСТ 3652-69;
кислоту молочную;
калий фосфорнокислый однозамещенный по ГОСТ 4198-75;
натрий азотнокислый по ГОСТ 4168-79;
магний сернокислый по ГОСТ 4523-77;
калий хлористый по ГОСТ 4234-77;
железо сернокислое окисное по ГОСТ 9485-74;
сахарозу по ГОСТ 5833-75;
(Измененная редакция, Изм. N 1).
1.4. Определение зараженности семян на питательной среде
1.4.1. Подготовка к анализу
1.4.1.1. Приготовление кислого картофельного агара
200 г вымытого, очищенного и нарезанного ломтиками картофеля заливают 1000 мл воды и кипятят в течение 40 мин, затем фильтруют. В отфильтрованную жидкость доливают воду до 1000 мл, добавляют 20 г агар-агара и подогревают до полного расплавления агара. Полученную среду разливают в колбы вместимостью 500 мл, добавляют 50%-ную лимонную кислоту (из расчета одна капля на 10 мл среды) или концентрированную молочную кислоту (из расчета 4 мл кислоты на 1000 мл среды). Колбы заполняют средой до половины объема, закупоривают ватными пробками и стерилизуют.
1.4.1.2. Приготовление среды Чапека
1 г фосфорнокислого однозамещенного калия, 2 г азотнокислого натрия, 0,50 г сернокислого магния, 0,50 г хлористого калия, 0,01 г сернокислого окисного железа и 30 г сахарозы взвешивают с погрешностью не более 0,01 г и растворяют в 500 мл воды комнатной температуры, затем добавляют 20 г агара, доливают водой до 1000 мл и подогревают до полного расплавления агара. Полученную среду разливают в колбы, закупоривают ватными пробками и стерилизуют.
1.4.1.3. Приготовление аграризированного пивного сусла
Неохмеленное пивное сусло разбавляют водой до 6-8%-ной концентрации сахара. На 1 л разбавленного сусла добавляют 20 г агар-агара и 0,15 г лиманной кислоты или 4 мл молочной кислоты и подогревают до полного расплавления агар-агара. Затем среду разливают в колбы, закупоривают ватными пробками и стерилизуют.
Перед употреблением ватные пробки стрелизуют в течение 1 ч при температуре 130 °С в сушильном шкафу.
Примечание. При необходимости очистки агар-агара от примесей его помещают в двойной марлевый мешочек и замачивают на 15-20 ч в воде. Затем мешочек с агар-агаром промывают в проточной воде или путем частой смены воды (не менее 8-10 раз) в течение 2-3 ч.
1.4.1.3а. Приготовление древесной среды для выявления гриба-возбудителя сосудистого микоза дуба.
200 г мелко нарезанных веток дуба высыпают в колбу, заливают 1000 мл воды, выдерживают в течение 12 ч при комнатной температуре, стерилизуют затем фильтруют. Объем полученного фильтрата доводят водой до 1000 мл, добавляют 20 г агар-агара. Полученную среду стерилизуют в колбах, закупоренных ватными пробками.
(Введен дополнительно, Изм. N 1).
1.4.1.4. Стерилизацию питательных сред проводят в автоклаве паром:
под давлением 1,0 Па (кг/см) в течение 30 мин или под давлением 1,5 Па (кг/см
) в течение 20 мин. За начало стерилизации принимают время, когда достигнуто необходимое давление;
без давления (три раза по 1 ч через сутки). За начало стерилизации принимают момент обильного выхода пара. В перерывах стерилизуемые питательные среды держат при температуре 25-30 °С.
1.4.1.5. Чашки Петри, пипетки, кружочки из фильтровальной бумаги стерилизуют в течение 1 ч при температуре 130 °С в сушильном шкафу. Боксы перед разливом среды и раскладкой семян дезинфицируют бактерицидными лампами, а термостаты перед загрузкой обрабатывают спиртом с последующим обжиганием спиртовым факелом.
1.4.1.6. Воду стерилизуют в автоклаве под давлением 1,0 Па (кг/см) в течение 30 мин или под давлением 1,5 Па (кг/см
) в течение 20 мин или кипятят в колбах, закрытых ватными пробками в течение 30 мин с момента закипания.
1.4.2. Проведение анализа
1.4.2.1. Разлив питательной среды в чашки Петри и раскладку семян производят в боксе. Толщина слоя среды в чашке Петри должна быть 3-4 мм. Семена раскладывают на застывшую питательную среду.
1.4.2.2. (Исключен, Изм. N 1).
1.4.2.3. В чашку Петри раскладывают по 50 мелких семян сосны, ели, шелковицы, спиреи, жимолости, бузины и других, близких к ним по размерам, или по 25 крупных семян пихты, караганы, яблони, груши и других, близких к ним по размерам, и по 5-10 семян клена, ореха и других, близких к ним по размерам семян.
1.4.2.4. Раскладку семян производят пинцетом или при помощи счетчика-раскладчика. При раскладке пинцетом семена раскладывают рядами по трафарету, подложенному под чашки Петри. Пинцет периодически дезинфицируют спиртом и огнем.
1.4.2.5. Для раскладки семян счетчиком-раскладчиком применяют насадки с отверстиями диаметром от 0,3 до 1,4 мм в зависимости от крупности семян, например:
для семян | пузыреплодника | - | 0,3-0,4 мм; |
" " | жимолости | - | 0,5-0,6 мм; |
" " | ели и сосны | - | 0,7-0,8 мм; |
" " | груши, лиственницы, яблони | - | 1,0-1,2 мм; |
" " | караганы, робиний | - | 1,4 мм. |
1.4.2.6. После тщательного перемешивания семена насыпают совочком на продезинфицированную спиртом и обожженную огнем рабочую поверхность насадки, включают счетчик-раскладчик, удаляют пинцетом лишние семена и заполняют семенами незанятые отверстия насадки. Затем насадку с семенами подносят к поверхности питательной среды, не прикасаясь к ней, и выключают счетчик-раскладчик.
1.4.2.7. На чашках Петри карандашом по стеклу проставляют номер образца и дату раскладки семян.
1.4.2.8. Чашки Петри с разложенными семенами заворачивают в крафт-бумагу, простерилизованную в автоклаве, и помещают на 5-6 суток в термостат с постоянной температурой 25-28 °С.
1.4.2.9. Просмотр семян производят на шестые или седьмые сутки. При определении наиболее распространенных грибов руководствуются рекомендуемыми приложениями 1-3.
При просмотре семян необходимо надевать респираторы или марлевые повязки.
1.4.2.10. Определение грибов
Сапрофитные грибы родов Aspergillus, Mucor, Penicillium, Rhisopus, Trichoderma, Hormiscium определяют визуально по форме и цвету колоний, а также по цвету их обратной стороны.
Сапрофитные грибы других родов определяют сначала визуально по явно выраженным колониям, затем под микроскопом с малым увеличением.
Паразитные грибы родов Alternaria, Fusarium, Verticillium, Phomopsis, Botrytis, Pythium de Baryanum, Rhizoctonia определяют только под микроскопом.
1.4.2.11. При сомнении в правильности определения грибов небольшую часть развившейся колонии исследуют в капле воды или 0,01%-ной уксусной кислоты под микроскопом при малом и большом увеличениях. Если споры грибов не обнаружены, то после определения других грибов чашки Петри оставляют на свету еще на 1-2 суток, затем колонии просматривают под микроскопом.
1.4.3. Обработка результатов
1.4.3.1. При просмотре каждой чашки Петри производят учет зараженности семян отдельно каждым паразитным и сапрофитным грибом. Учету подлежат все колонии грибов, образовавшиеся на семенах и вокруг них.
Колонии паразитных грибов учитывают отдельно по каждому роду гриба в процентах от количества разложенных семян. Вычисления производят до целого числа.
Колонии сапрофитных грибов учитывают в процессе просмотра семян и оценивают их зараженность каждым грибом по степени встречаемости:
единичная - до 5% зараженных семян;
слабая - до 25% зараженных семян;
средняя - до 50% зараженных семян;
сильная - более 50% зараженных семян.
1.5. Определение зараженности семян во влажной камере
1.5.1. Подготовка к анализу
1.5.1.1. Приготовление влажной камеры
В чашки Петри по размеру дна чашки укладывают по два-три кружка фильтровальной бумаги и стерилизуют их в автоклаве под давлением 1,0 Па (кг/см) в течение 30 мин или под давлением 1,5 Па (кг/см
) в течение 20 мин или в сушильном шкафу в течение 1 ч при 130 °С.
После стерилизации фильтровальную бумагу в чашках Петри увлажняют стерилизованной или свежекипяченой водой до полной влагоемкости при помощи пипетки, слегка приоткрывая при этом с одного края крышку чашки.
Увлажнение считают нормальным, если при наклоне чашки с кружков стекают мелкие капли воды.
1.5.1.2. (Исключен, Изм. N 1).
1.5.1.3. Перед раскладкой семена обеззараживают с поверхности путем:
быстрого проведения через пламя спиртовки с помощью пинцета;
путем опускания в спирт на 1 мин;
путем стерилизации 0,5%-ным раствором марганцевокислого калия в течение 1 ч с последующим промыванием стерилизованной или свежекипяченой водой.
(Измененная редакция, Изм. N 1).
1.5.2. Проведение анализа
1.5.2.1. Обеззараженные семена пинцетом раскладывают во влажную камеру.
1.5.2.2. Дальнейший анализ проводят в соответствии с пп.1.4.2.7-1.4.2.11 и 1.4.3.
2. МАКРОСКОПИЧЕСКИЙ МЕТОД
2.1. Макроскопический метод применяют для определения внешних изменений, вызванных развивающимися грибами в семенах всех видов березы, ольхи, дуба, тополя, ели и караганы древовидной.
Примечание. У семян всех видов березы и ольхи зараженность грибами другими методами не определяют.
2.2. Анализ проводят одновременно с определением чистоты семян по ГОСТ 13056.2-67*.
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ 13056.2-89, здесь и далее по тексту. - Примечание изготовителя базы данных.
2.3. Аппаратура и материалы
2.3.1. Для проведения анализа применяют:
лупу по ГОСТ 25706-83;
пинцет.
2.4. Проведение анализа
Навеску семян осматривают невооруженным глазом или с помощью лупы и выделяют деформированные семена, а также семена со склероциями и с явно выраженным спороношением.
2.5. Признаки, по которым устанавливают зараженность, и способы учета зараженности указаны в таблице.
Порода | Признаки зараженности |
Береза | Склероции в виде черного подковообразного ободка в верхней части семени |
Ольха | Склероции в виде черного ободка вокруг семени. |
Дуб | Склероции в виде черного или бурого цвета, губчатой структуры или серый мицелий, выступающий на треснувшей кожуре желудя. На поверхности кожуры желудя сильно выступающие бугорки, которые образуют звездообразный разрыв кожуры |
Тополь | Деформация - семена сильно увеличены в объеме (вздутые) |
Ель | На внешней или внутренней стороне чешуек шишки многочисленные шаровидные плотные эцидии оранжевого или темно-коричневого цвета - ржавчина |
Карагана древовидная | На сморщенных семенах склероции - матово-черные бугорки |
2.6. Обработка результатов
2.6.1. Зараженность семян всех видов березы, ольхи, караганы древовидной, дуба и тополя учитывают в процентах от массы навески по ГОСТ 13056.2-67.
2.6.2. Зараженность семян всех видов ели определяют только по тому: обнаружена ржавчина или не обнаружена.
3. МЕТОД ЦЕНТРИФУГИРОВАНИЯ
3.1. Метод центрифугирования используют для ускоренного или предварительного фитопатологического анализа семян. Этим методом определяют только наличие спор грибов родов Alternaria, Fusarium, Helminthosporium, Stemphylium, Mycogone, Trichothecum, находящихся на поверхности семян.
3.2. Аппаратура, материалы и реактивы
3.2.1. Для проведения анализа применяют:
центрифугу;
микроскоп;
пипетки;
пробирки по ГОСТ 25336-82;
колбы плоскодонные по ГОСТ 25336-82;
стекла предметные по ГОСТ 9284-75;
стекла покровные по ГОСТ 6672-75;
воду стерилизованную или свежекипяченую.
3.3. Подготовка к анализу
3.3.1. Для анализа из разных мест среднего образца, отобранного по ГОСТ 13056.1-67, берут две пробы по 100 семян.
3.3.2. Колбы и пробирки обеззараживают в автоклаве под давлением 1,0 Па (кг/см) в течение 30 мин или под давлением 1,5 Па (кг/см
) в течение 20 мин.
3.4. Проведение анализа
3.4.1. Пробы помещают в стерильные колбы, заливают 10-20 мл воды комнатной температуры и взбалтывают. Семена с гладкой поверхностью взбалтывают в течение 5 мин, с шероховатой - в течение 10 мин.
После взбалтывания суспензию от каждой пробы сливают в стерильные пробирки центрифуги, заполняя каждую пробирку на вместимости и подвергают центрифугированию в течение 3 мин. Частота вращения центрифуги должна быть 50-60 об/мин. Если в центрифуге не все пробирки заняты, то свободные пробирки заполняют для равновесия чистой водой до того же уровня. По окончании центрифугирования воду из каждой пробирки сливают, оставляя слой воды 1,5-2,0 см, осадок взмучивают и из него готовят пять препаратов. Для каждого препарата берут пипеткой одну каплю взвеси, помещают ее на предметное стекло и покрывают покровным стеклом.
3.5. Препараты просматривают под микроскопом по всей площади покровного стекла и устанавливают наличие спор и род грибов.
ПРИЛОЖЕНИЕ 1 (рекомендуемое). ПАРАЗИТНЫЕ ГРИБЫ - ВОЗБУДИТЕЛИ ИНФЕКЦИОННОГО ПОЛЕГАНИЯ ВСХОДОВ
ПРИЛОЖЕНИЕ 1
Рекомендуемое
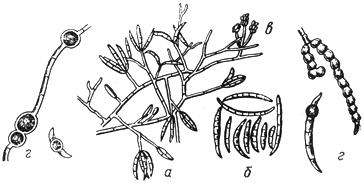
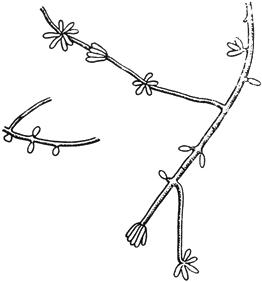
Черт.1. Ботритис - Botritis cinerea Pers.
Ботритис - Botritis cinerea Pers.
- конидиеносцы с конидиями; б - конидии
Черт.1
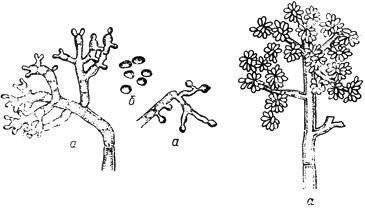
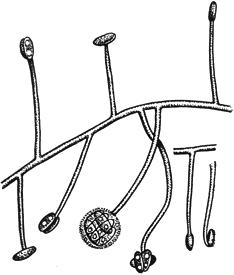
Черт.2. Питиум - Pythium de Baryanum Hesse
Питиум - Pythium de Baryanum Hesse
- зооспорангий; б - ооспора; в - антеридий
Черт.2
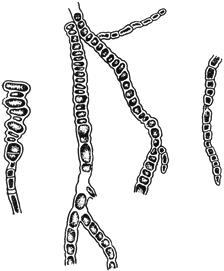
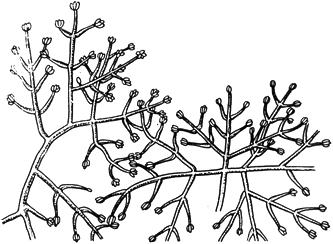
Черт.3. Альтернария - Alternaria Nees
Альтернария - Alternaria Nees
Конидиеносцы с цепочками конидий
Черт.3
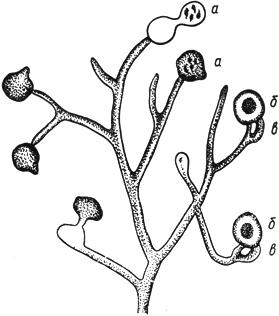
Черт.4. Фузариум - Fusarium Link
Фузариум - Fusarium Link
- конидиеносцы с конидиями; б - макроконидии; в - микроконидии; г - хламидоспоры - промежуточные и в цепочках
Черт.4
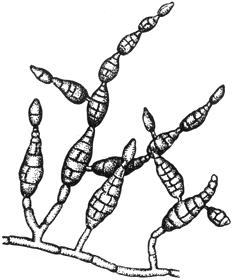
Черт.5. Вертициллиум - Verticillium Nees
Вертициллиум - Verticillium Nees
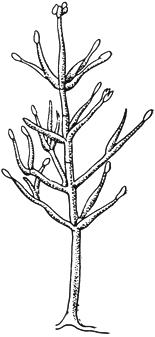
Конидиеносец с конидиями на концах
Черт.5
ПРИЛОЖЕНИЕ 2 (рекомендуемое). САПРОФИТНЫЕ ГРИБЫ, ВЫЗЫВАЮЩИЕ ЗАГНИВАНИЕ СЕМЯН ПРИ ХРАНЕНИИ
ПРИЛОЖЕНИЕ 2
Рекомендуемое
Черт.1. Пенициллиум - Penicillium Link
Пенициллиум - Penicillium Link
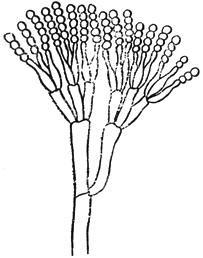
Конидиеносец с цепочками конидий
Черт.1
Черт.2. Аспергиллус - Aspergillus mich
Аспергиллус - Aspergillus mich
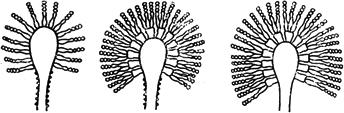
Конидиеносцы с конидиями
Черт.2
Черт.3. Моноспориум - Monosporium Bonorden
Моноспориум - Monosporium Bonorden
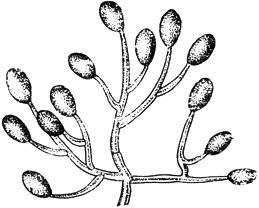
Конидиеносец с одиночными конидиями
Черт.3
Черт.4. Спикария - Spicaria Harting
Спикария - Spicaria Harting
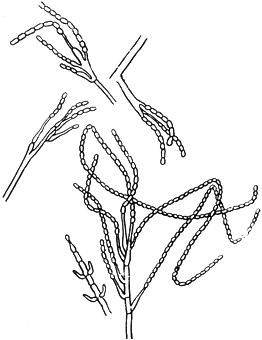
Конидиеносец с цепочками конидий
Черт.4
Черт.5. Ризопус - Rhizopus Ehrenb
Ризопус - Rhizopus Ehrenb
- спорангиеносцы со спорангиями; б - столоны; в - ризоиды
Черт.5
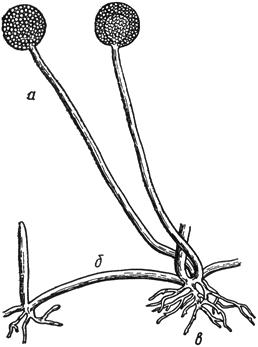
Черт.6. Эдоцефалум - Oedocephalum Preuss
Эдоцефалум - Oedocephalum Preuss
- конидиеносцы с головками конидий; б - хламидоспоры
Черт.6
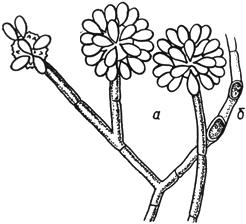
Черт.7. Гормисциум - Hormiscium Kunze
Гормисциум - Hormiscium Kunze
Цепочки конидий
Черт.7
Черт.8. Кладоспориум - Cladosporium Link
Кладоспориум - Cladosporium Link
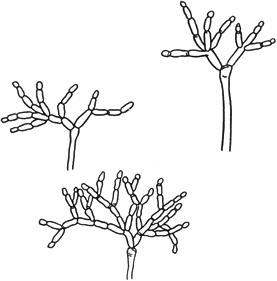
Конидиеносцы с конидиями
Черт.8
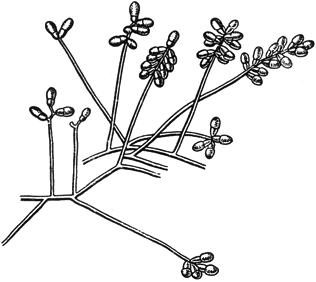
Черт.9. Монилия - Monilia Pers
Монилия - Monilia Pers
Конидиеносцы с цепочками конидий
Черт.9
Черт.10. Трихотециум - Trichothecium Link
Трихотециум - Trichothecium Link
Конидиеносцы с конидиями
Черт.10
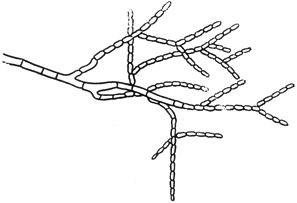
Черт.11. Цилиндроцефалум - Cylidrocephalum Lindau
Цилиндроцефалум - Cylidrocephalum Lindau
- спорангий; б - споры; в - столбик; г - хламидоспоры; д - спорангиеносец со спорангиями
Черт.11
Черт.12. Мукор - Mucor Mich
Мукор - Mucor Mich
Конидиеносцы с конидиями
Черт.12
Черт.13. Гельминтоспориум - Helmintosporium Link
Гельминтоспориум - Helmintosporium Link
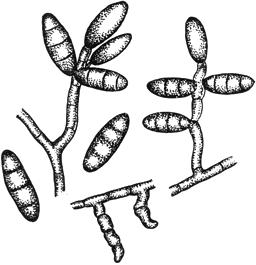
Конидиеносцы с конидиями
Черт.13
Черт.14. Цефалоспориум - Cephalosporium Corda
Цефалоспориум - Cephalosporium Corda
Конидиеносцы с конидиями
Черт.14
Черт.15. Триходерма - Trichoderma Pers
Триходерма - Trichoderma Pers
Конидиеносцы с конидиями
Черт.15
Черт.16. Стемфилиум - Stemphylium Wallr
Стемфилиум - Stemphylium Wallr
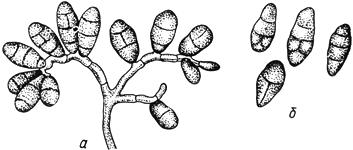
- конидиеносец с конидиями; б - конидии
Черт.16
Черт.17. Пуллулария - Pullularia Berkh
Пуллулария - Pullularia Berkh
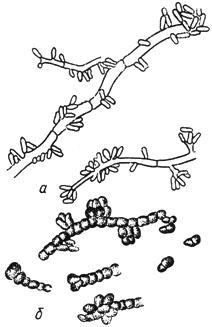
- тонкостенные гифы с конидиями; б - гифы с толстостенными клетками
Черт.17
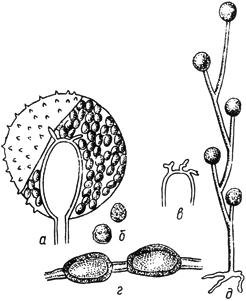
Черт.18. Хетомиум - Chaetomium Kunze
Хетомиум - Chaetomium Kunze
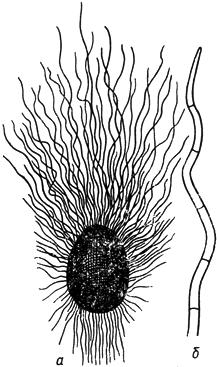
- перитеций; б - волосок при большом увеличении
Черт.18
ПРИЛОЖЕНИЕ 3 (рекомендуемое). ГРИБЫ, ВЫЗЫВАЮЩИЕ ЗАГНИВАНИЕ СЕМЯН В РЕЗУЛЬТАТЕ АНТИСАНИТАРНЫХ УСЛОВИЙ ПРИ СБОРЕ И ОБРАБОТКЕ
ПРИЛОЖЕНИЕ 3
Рекомендуемое
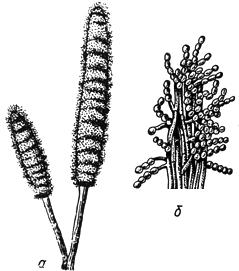
Черт.1. Сордария - Sordaria Ces. et de Not
Сордария - Sordaria Ces. et de Not
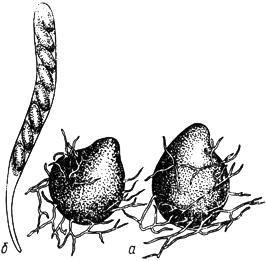
- перитеций; б - сумка с аскоспорами
Черт.1
Черт.2. Пилоболус - Pilobolus Tode
Пилоболус - Pilobolus Tode
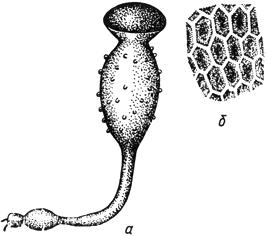
- спорангиеносец; б - оболочка спорангия
Черт.2
Черт.3. Глиокладиум - Gliocladium Corda
Глиокладиум - Gliocladium Corda
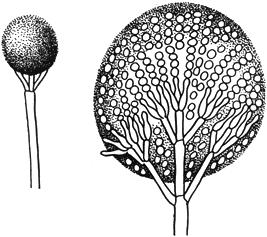
Конидиеносцы со слизистым шаровидным скоплением конидий
Черт.3
Черт.4. Тамнидиум - Thamnidium Link
Тамнидиум - Thamnidium Link
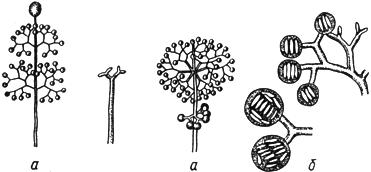
Спорангиеносец со спорангиями (спорангиолями): - при малом увеличении; б - при большом увеличении
Черт.4
Черт.5. Стизанус - Stysanus Corda
Стизанус - Stysanus Corda
Коремии с конидиями - при малом увеличении; б - при большом увеличении
Черт.5
Черт.6. Хетостилум - Chaetostylum Fresenii
Хетостилум - Chaetostylum Fresenii
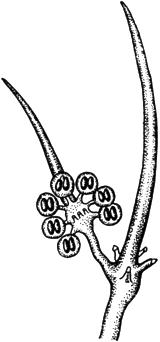
Спорангиоли и бесплодные острия
Черт.6
Черт.7. Хетокладиум - Chaetocladium Brefeldii
Хетокладиум - Chaetocladium Brefeldii
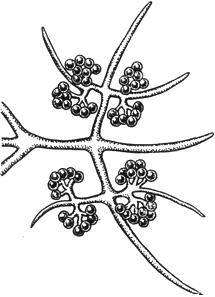
Грозди конидий
Черт.7