ГОСТ Р ИСО 13683-2000
Группа Р26
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукции
ТРЕБОВАНИЯ К ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ
Стерилизация влажным теплом в медицинских учреждениях
Sterilization of health care products. Requirements for validation and routine control of moist heat sterilization in health care facilities
ОКС 11.080
ОКП 94 5120
Дата введения 2002-01-01
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) и Московской медицинской академией им. И.М.Сеченова
ВНЕСЕН Техническим комитетом по стандартизации ТК 383 "Стерилизация медицинской продукции" Госстандарта России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 18 сентября 2000 г. N 225-ст
3 Настоящий стандарт содержит аутентичный текст международного стандарта ИСО 13683-97 "Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Стерилизация влажным теплом в медицинских учреждениях"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Лица, ответственные за безопасность стерильной медицинской продукции, должны знать процессы стерилизации, методы контроля и физические характеристики стерилизуемого продукта. Продукты, производимые в контролируемых условиях, содержат микроорганизмы и являются по определению нестерильными. Целью стерилизации является разрушение этих микробиологических контаминантов. После стерилизации, однако, существует некоторая вероятность того, что, несмотря на обработку, микроорганизмы могут выжить. Как следствие, стерильность обработанных предметов выражается вероятностью выживания одного микроорганизма в продукции.
Требования к системе качества при проектировании, разработке, производстве, поставке, монтаже и обслуживании медицинской продукции приведены в стандартах серии ГОСТ Р ИСО 9000.
Международные стандарты серии ГОСТ Р ИСО 9000 определяют некоторые процессы, используемые в производстве медицинской продукции как "специальные", если результат не может быть полностью проверен последующим контролем и испытанием продукции. Стерилизация является примером специального процесса, поскольку ее эффективность не может быть проверена контролем продукта. Поэтому процесс стерилизации должен быть валидирован до практического применения и подлежит текущему контролю, а оборудование - необходимому обслуживанию.
1 Область применения
1 Область применения
1.1 Требования, включенные в стандарт
1.1.1 Настоящий стандарт содержит требования к стерилизации влажным теплом, валидации и контролю процесса стерилизации как в медицинских учреждениях, так и в организациях, работающих по договору с ними.
1.1.2 Настоящий стандарт распространяется на все процессы с использованием влажного тепла в медицинских учреждениях, где в качестве стерилизующих агентов применяется пар, паровоздушная смесь или перегретая вода.
Примечание - Основные требования настоящего стандарта могут применяться при стерилизации фармацевтической продукции, но для нее могут потребоваться и другие технические и руководящие указания.
1.2 Положения, не включенные в стандарт
1.2.1 В настоящем стандарте не рассматриваются системы обеспечения качества для контроля на всех стадиях производства.
Примечание - Следует учитывать международные стандарты по системам качества (ИСО 13485 или ИСО 13488), которые касаются контроля всех стадий производства, включая процессы стерилизации. Настоящий стандарт не содержит требований к организации системы качества в процессе производства, но на некоторые элементы такой системы даны нормативные ссылки в тексте.
1.2.2 Настоящий стандарт не содержит частных требований ко всем видам оборудования, используемого в системах стерилизации (например, оборудования для мытья).
1.2.3 Настоящий стандарт не распространяется на процессы стерилизации, при которых в качестве стерилизующего агента используют смесь пара и химического вещества.
1.2.4 Настоящий стандарт не применяется для промышленной стерилизации влажным теплом, которая рассматривается в ГОСТ Р ИСО 11134.
2 Нормативные ссылки
В настоящем стандарте приведены ссылки на следующие стандарты:
ГОСТ Р ИСО 9001-96* Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96* Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании
________________
* На территории Российской Федерации действует ГОСТ Р ИСО 9001-2008, здесь и далее по тексту. - Примечание изготовителя базы данных.
ГОСТ Р ИСО 11138-1-2000 Стерилизация медицинской продукции. Биологические индикаторы. Часть 1. Общие требования
ГОСТ Р ИСО 11138-3-2000 Стерилизация медицинской продукции. Биологические индикаторы. Часть 3. Биологические индикаторы для стерилизации влажным теплом
ГОСТ Р ИСО 11737-1-2000 Стерилизация медицинской продукции. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов в продукции
ГОСТ Р 51350-99 (МЭК 61010-1-90) Безопасность электрических контрольно-измерительных приборов и лабораторного оборудования. Часть 1. Общие требования
ГОСТ Р МЭК 61010-2-041-99 Безопасность электрических контрольно-измерительных приборов и лабораторного оборудования. Часть 2-041. Частные требования к лабораторным автоклавам, в том числе использующим пар для обработки медицинских материалов
ИСО 10012-1-92* Требования к обеспечению качества измерительного оборудования. Часть 1. Системы метрологического обеспечения для оборудования
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
ИСО 11607-97* Упаковка для медицинских изделий, подлежащих финишной стерилизации
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
ИСО 13485-96* Системы качества. Медицинские изделия. Частные требования к применению стандарта ИСО 9001
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
ИСО 13488-96* Системы качества. Медицинские изделия. Частные требования к применению стандарта ИСО 9002
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
3 Определения
В настоящем стандарте использованы термины с соответствующими определениями:
3.1 паровоздушная смесь (air-steam mixture): Однородная смесь воздуха и насыщенного пара, используемая для стерилизации.
Примечание - Воздух используют для компенсации давления, возникающего в герметичных контейнерах и превышающего давление насыщенного пара.
3.2 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов в сырье, материалах, конечном продукте и/или в упаковке.
3.3 аттестация: Процесс документированного рассмотрения и утверждения пригодности, осуществляемый на завершающей стадии программы валидации с целью разрешения выпуска продукции.
3.4 величина (
value): Время выдержки при определенных условиях обработки, необходимое для уменьшения популяции конкретного тест-микроорганизма в 10 раз.
3.5 электромеханический контроль (electrоmechanical control): Контрольная система, использующая механические средства (например, копиры или перфокарты) для согласования и подачи электрических сигналов.
3.6 средства контроля производственной среды (environmental control): Средства контроля и мероприятия, принятые в производственных помещениях с целью регулирования бионагрузки.
Примечание - Сюда могут входить воздушные и жидкостные фильтры, дезинфекция поверхностей, рабочая одежда персонала и организационные меры.
3.7 величина (
value): Мера способности тепловой стерилизационной обработки инактивировать микроорганизмы.
3.8 величина (
value): Величина
, рассчитанная при температуре 121 °С, величине
, равной 10 °С, и величине
, равной 1 мин.
3.9 медицинское учреждение (health care facility): Организация, вместе с обслуживающими ее субподрядчиками, которая представляет любые формы медицинского обслуживания пациентов.
3.10 медицинская продукция (health care products): Медицинские изделия, лекарственные (фармацевтические и биологические) и диагностические средства.
3.11 микробиологический тест (microbiological challenge): Биологические индикаторы, тест-пакеты с биологическими индикаторами или инокулированный продукт, которые содержат известную популяцию микроорганизмов и могут быть использованы для проверки циклов стерилизации.
3.12 пористый материал (porous material): Материал или структура продукта, требующие проникания пара внутрь продукта для осуществления его стерилизации.
3.13 первичная упаковка (primary packaging): Элемент упаковочной системы, который сохраняет стерильность продукции.
3.14 летальность процесса (process lethality): Способность процесса стерилизации инактивировать микроорганизмы.
Примечание - Летальность определяют путем количественной оценки гибели микроорганизмов или путем установления и измерения требуемых физических параметров.
3.15 приемка (комиссионная приемка, комиссионная проверка) (commissioning): Получение и документирование доказательства того, что оборудование поставлено и смонтировано в соответствии с документацией и работает в определенных допусках при условии соблюдения инструкций по эксплуатации.
3.16 повторная приемка (повторная комиссионная приемка, повторная комиссионная проверка) (recommisioning): Повторение приемки полностью или частично для подтверждения надежности процесса.
3.17 ревалидация (revalidation): Комплекс документированных процедур для подтверждения ранее проведенной валидации.
3.18 насыщенный пар (saturated steam): Водяной пар в состоянии равновесия между конденсацией и испарением.
3.19 имитатор загрузки (simulated product load): Загрузка, заменяющая целевую загрузку и обеспечивающая эквивалентное или большее противодействие обработке.
3.20 стерильный (sterile): He содержащий жизнеспособных микроорганизмов.
Примечание - На практике состояние абсолютного отсутствия микроорганизмов не может быть доказано (см. стерилизация).
3.21 стерилизация (sterilization): Валидированный процесс освобождения продукта от всех форм жизнеспособных микроорганизмов.
Примечание - При стерилизации процесс отмирания микроорганизмов описывается экспоненциальным законом. Следовательно, наличие микроорганизмов в конкретном объекте может быть выражено в вероятностном виде. Эта вероятность может быть снижена до весьма малой величины, но никогда не может быть снижена до нуля.
3.22 цикл стерилизации (sterilization cycle): Заданная последовательность рабочих стадий, предназначенных для достижения стерилизации и выполняемых в закрытой камере.
3.23 разработка процесса стерилизации (sterilization process development): Исследования и разработка воспроизводимого процесса, с помощью которого продукт может быть стерилизован без повреждения до желаемой вероятности сохранения нестерильных единиц.
3.24 валидация (validation): Документированная процедура получения, протоколирования и интерпретации результатов, необходимых для демонстрации того, что процесс неизменно дает продукт, соответствующий предварительно определенным требованиям.
Примечание - Валидация включает три действия: комиссионную проверку, проверку процесса на соответствие требованиям и аттестацию в эксплуатации.
3.25 величина (
value): Изменение температуры, необходимое для изменения величины
в 10 раз.
3.26 система стерилизации (sterilization system): Комплекс методов и оборудования, включая стерилизацию, необходимый для перевода потенциально контаминированного продукта в стерильное и безопасное для использования состояние.
3.27 камерная фурнитура (chamber furniture): Средство внутри камеры стерилизатора для размещения загрузки.
3.28 продукт (product): Общее понятие для обозначения сырья, промежуточных продуктов и готовой продукции.
4 Общие положения
(см. приложение А)
4.1 Ответственность и подготовка персонала
Ответственность за монтаж и обслуживание стерилизаторов влажным теплом, валидацию и текущий контроль стерилизации влажным теплом, а также выпуск стерилизованной продукции должна быть возложена на квалифицированный персонал, как это предусмотрено требованиями ГОСТ Р ИСО 9001 (или ИСО 13485) или ГОСТ Р ИСО 9002 (или ИСО 13488).
4.2 Одежда
Должны быть определены и документированы требования к верхней одежде, предназначенной для использования в каждом помещении, где проводятся стерильные процессы.
4.3 Требования к продукту
Продукт и материалы, подлежащие стерилизации влажным теплом, должны быть совместимы с физическими условиями и изменениями среды внутри стерилизационной камеры. Эта информация должна быть документирована и получена от поставщика или составлена медицинским учреждением.
Для продуктов, предназначенных для повторного использования, поставщиком должно быть представлено документальное свидетельство того, что процедуры, рекомендованные для деконтаминации, очистки и стерилизации продукта, являются эффективными. Оценка этих процедур должна проводиться в процессе валидации.
4.4 Требования к упаковке
4.4.1 Общие положения
4.4.1.1 Упаковочные материалы и правила работы с ними должны быть приведены в технической документации.
4.4.1.2 Упаковочные материалы должны быть совместимыми с условиями среды внутри стерилизатора в процессе стерилизации.
4.4.1.4** Упаковочные материалы должны соответствовать стандарту ИСО 11607*.
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
** Нумерация соответствует оригиналу. - Примечание изготовителя базы данных.
4.4.2 Проницаемость упаковки
Упаковка должна обеспечивать условия стерилизации на поверхности или внутри продукта как путем удаления воздуха, так и проникания пара; или для непроницаемой упаковки, такой как, например, флаконы для водных растворов - теплопередачей.
При хранении и транспортировании упаковка должна предохранять продукт от механического повреждения и обеспечивать стерильность медицинской продукции к моменту использования.
5 Оборудование
(см. приложение А)
5.1 Документация
5.1.1 Данные об оборудовании
На каждом стерилизаторе и парогенераторе должны быть одна или более информационных табличек, закрепляемых на оборудовании и содержащих следующую информацию на языке пользователя:
a) наименование и адрес изготовителя;
b) заводской номер или иное обозначение оборудования;
c) расчетное давление в камере и максимальная рабочая температура;
d) давление в рубашке (если необходимо);
e) отметка инспектора надзора и идентификационная маркировка сосуда;
f) дата изготовления сосуда;
g) стандартное давление, на которое рассчитан сосуд (если необходимо).
Должно быть документировано и подтверждено соответствие системы стерилизации требованиям безопасности по ГОСТ Р 51350 и ГОСТ Р МЭК 61010-2-041.
5.1.2 Безопасность
5.1.3 Указания и инструкции
Для каждого стерилизатора на языке (языках), согласованном(ых) с пользователем, должна быть дана следующая обязательная информация:
a) инструкции по монтажу системы стерилизации, достаточные для безопасной и эффективной работы оборудования;
b) перечень конструктивных материалов сосуда и фурнитуры камеры, находящихся в контакте со стерилизующим агентом;
c) инструкции по безопасной и эффективной работе, включая рекомендации по предельно допустимым значениям температуры и давления в сосуде;
d) инструкции и рекомендуемый перечень операций по техническому обслуживанию, включая перечень заменяемых частей и специальный инструмент для обслуживания;
e) схемы камеры, показывающие ее форму и конструкцию, трубопроводы и принципиальные схемы системы контроля, рекомендуемые схемы монтажа и перечень запасных частей всех ответственных узлов системы;
f) схема управления процессов и/или программное обеспечение, необходимое для работы и обслуживания системы контроля (см. 5.2.6);
g) указания по замене или ревизии программного обеспечения, включая документацию, подтверждающую проведение валидации.
5.1.4 Дополнительная информация
Пользователь должен иметь и вести документацию об испытаниях установки.
5.2 Эксплуатационные характеристики стерилизатора, технологические среды и источники энергии, материалы, принадлежности и средства контроля
5.2.1 Эксплуатационные характеристики
У пользователя должны быть данные, подтверждающие, что стерилизатор соответствует своим техническим характеристикам.
5.2.2 Технологические среды и источники энергии
5.2.2.1 Чистота и качество пара должны быть стандартизованы, и должно быть подтверждено, что требуемое качество стерилизуемого продукта не ухудшается. Эти показатели должны быть документированы.
5.2.2.2 Чистота сжатого воздуха, используемого в стерилизационной камере, должна быть такой, чтобы безопасность продукта не снижалась. Это должно быть документировано.
5.2.2.3 Окружающий воздух, поступающий в камеру при сбросе вакуума, должен проходить через фильтр, задерживающий микроорганизмы. Характеристики фильтра должны быть документированы.
5.2.2.4 Качество воды, используемой в стерилизаторе для охлаждения продукта, должно быть указано в технической документации. При этом должно быть подтверждено, что она не контаминирует продукт. Этот факт должен быть документирован.
5.2.2.5 Электропитание, подводимое к системе стерилизации, должно соответствовать требованиям изготовителя стерилизатора. Это должно быть документировано.
5.2.3 Материалы
Пользователь должен гарантировать, что свойства компонентов и материалов, выбранных для конструкции системы стерилизации, сводят к минимуму вероятность микробиологической или химической контаминации. Это должно быть документировано.
5.2.4 Принадлежности
Пользователь должен выбрать оснастку камеры так, чтобы она позволяла пару равномерно проникать во внутренние полости камеры и/или обеспечивать нормальную теплопередачу и осуществлять дренаж конденсата.
5.2.5 Системы контроля и регистрации данных
5.2.5.1 Система управления должна поддерживать температуру в пределах, указанных для конкретного процесса стерилизации.
Должны автоматически контролироваться и записываться (как функция времени) следующие параметры процесса:
a) температура в камере;
b) давление в камере;
c) скорость изменения температуры и давления.
Результаты контроля должны регистрироваться.
Записывающее устройство и система контроля должны быть независимыми. Они должны подавать сигнал во время цикла стерилизации или в конце цикла в том случае, если различия между контролируемыми и записываемыми переменными превышают допустимые пределы. Регистрируемые данные должны быть достаточны для того, чтобы можно было проводить последующие анализы.
5.2.5.2 Чтобы обеспечить надежность контроля в загрузке, датчики температуры, используемые в процессе контроля и мониторинга, должны располагаться в местах, определяемых предварительным изучением распределения температур.
5.2.6 Программы контроля
Пользователь должен гарантировать, что программные устройства, используемые для управления и контроля процесса стерилизации, валидированы. Контрольные программы должны быть оформлены документально. Правильность их работы должна быть продемонстрирована как при имитации процесса, так и в реальном процессе. Любые последующие изменения следует документировать аналогичным образом и оценивать с точки зрения необходимости ревалидации.
5.3 Требования к приборам
5.3.1 Точность приборов
5.3.1.1 Точность приборов должна быть указана в технической документации.
5.3.1.2 Точность приборов, применяемых для валидации, должна превышать точность управляющей и записывающей систем.
5.3.1.3 Датчики температуры и давления должны гарантировать установленную точность.
5.3.2 Калибровочные эталоны
Должна быть указана точность эталонов, используемых для калибровки измерительных приборов. Калибровка должна быть прослеживаемой до национального стандарта, как это предусмотрено ГОСТ Р ИСО 9001, ГОСТ Р ИСО 9002, и должна соответствовать ИСО 10012-1.
5.3.3 Программа калибровки
Следует принять, документировать и выполнять необходимые инструкции по калибровке всех контролирующих, показывающих и записывающих приборов, применяемых для валидации и текущего контроля цикла стерилизации. Эта процедура должна основываться на требованиях ГОСТ Р ИСО 9001 или ГОСТ Р ИСО 9002.
5.4 Техническое обслуживание
5.4.1 Оборудование должно обслуживаться в соответствии с документально оформленным графиком технического обслуживания и ремонта.
5.4.2 Лицо, выполняющее техническое обслуживание, должно иметь документ, подтверждающий его квалификацию по обслуживанию конкретного стерилизатора.
5.4.3 Работы по проведению каждого планового обслуживания и их периодичность должны быть определены и документированы.
5.4.4 Не допускается использовать стерилизатор в производстве медицинской продукции до тех пор, пока не будут проведены и документально оформлены все плановые и необходимые внеплановые процедуры по обслуживанию.
5.4.5 Документация о проведении технического обслуживания должна храниться совместно с документацией на оборудование.
5.4.6 Графики и инструкции по техническому обслуживанию оборудования, а также документация о проведении обслуживания должны периодически пересматриваться ответственным лицом. Это лицо должно быть назначено в соответствии с требованиями ГОСТ Р ИСО 9001 или ГОСТ Р ИСО 9002.
6 Разработка процесса стерилизации
(см. приложение А)
6.1 Все этапы процесса стерилизации должны быть разработаны так, чтобы обеспечивалась воспроизводимость процесса во время текущего производства. Эти этапы должны включать:
a) очистку/деконтаминацию;
b) проверку;
c) комплектацию;
d) упаковку;
e) загрузку;
f) выдерживание в условиях стерилизации;
g) разгрузку;
h) хранение;
i) распределение.
6.2 Процедуры и материалы, используемые на каждом этапе процесса, должны быть документированы, и каждая задача должна выполняться подготовленным персоналом.
6.3 Во всех случаях должна применяться стерилизация насыщенным паром, за исключением случаев, когда в соответствии с документацией на продукцию существует риск для продукции.
Паровоздушные смеси следует применять только вместе с эффективной циркуляцией, создающей однородную тепловую среду внутри стерилизатора.
Воспроизводимость среды внутри камеры должна быть показана экспериментально.
6.4 Должно быть показано обеспечение условий стерилизации продукта при вновь разработанных циклах стерилизации влажным теплом.
6.5 Эффективность цикла стерилизации должна оцениваться, исходя из достижения требуемых физических параметров.
6.6 Любые микробиологические испытания должны сопровождаться измерением физических параметров.
6.7 При использовании индикаторных микроорганизмов их выбирают с учетом особенностей процесса стерилизации и соответствия требованиям ГОСТ Р ИСО 11138-1 и ГОСТ Р ИСО 11138-3.
7 Валидация процесса стерилизации
(см. приложение А)
7.1 Программу валидации проводят на основе утвержденного протокола по ГОСТ Р ИСО 9002.
7.2 Следует провести приемку каждого стерилизатора продукции после монтажа. Следует валидировать процесс стерилизации при изменениях в продукции и условиях проведения процесса, а также для нового стерилизационного оборудования.
7.3 Валидация должна быть поручена ответственному лицу, имеющему опыт проведения такой работы.
7.4 Приемка должна включать:
a) демонстрацию соответствия установленного оборудования техническим характеристикам;
b) проверку документации на оборудование (5.1);
c) демонстрацию соответствия качества и работоспособности используемых систем;
d) проверку того, что рабочие и контрольные приборы калиброваны;
e) если необходимо, демонстрацию эффективности системы удаления воздуха;
f) демонстрацию соответствия эксплуатационным характеристикам.
7.5 Аттестация в эксплуатации должна показать, что процесс стерилизации воспроизводим и подтверждает:
a) однородность физических параметров в установленных пределах внутри камеры и загрузки;
b) соотношение между контрольными и фактическими параметрами в загрузке;
c) зависимость между физическими параметрами и летальностью по данным литературы или проведенным исследованиям;
d) соответствие требованиям при максимальной и минимальной загрузках;
e) приемлемость пределов перемешивания продукта внутри загрузки;
f) репрезентативность имитирующей загрузки (если она применяется) по отношению к реальной загрузке;
g) то, что загрузка для целей аттестации, которая будет использоваться повторно, перед повторным использованием снова будет соответствовать установленным условиям.
7.6 Должно быть определено число датчиков температуры и циклов стерилизации для проведения первичной и повторной аттестаций в эксплуатации. Оно должно быть достаточным для подтверждения соответствия процесса разработанным техническим условиям.
7.7 До и после каждой программы последовательного тестирования следует проверять, что используемые при валидации систем измерения температуры калиброваны.
7.8 На этапе завершения валидации следует рассмотреть и утвердить полученные данные.
7.9 Ревалидация должна быть проведена после существенного ремонта системы стерилизации, который может повлечь за собой изменение эффективности процесса. Ревалидация должна проводиться не реже одного раза в 12 мес.
7.10 Процедуры ревалидации, проверки и изменения процесса, системы стерилизации (оборудования и программы) продукта и упаковки должны быть документированы. Ответственность за определение необходимости и объема повторяемых этапов первичной валидации должна быть возложена на подготовленный персонал.
При изменениях в оборудовании или системе контроля необходимо проводить оценку того, что параметры процесса, которому подвергается загруженный в стерилизатор продукт, соответствуют данным, полученным при первоначальной аттестации.
8 Текущая стерилизация влажным теплом
(см. приложение А)
8.1 Контроль процесса паровой стерилизации
8.1.1 Точность и надежность приборов, используемых для контроля каждого производственного цикла, следует периодически проверять в соответствии с документацией на них.
8.1.2 Следует иметь документированные инструкции текущего контроля цикла стерилизации.
8.1.3 При каждом цикле должны составляться протоколы, содержащие следующие данные:
a) дату;
b) название стерилизатора и заводской номер;
c) обозначение цикла;
d) фамилию и подпись оператора;
e) описание загрузки и номер серии;
f) время начала цикла (реальное время);
g) давление в камере в течение данного цикла;
h) температуру в камере в течение данного цикла.
8.2 Контроль изменений
Система документирования должна гарантировать, что в оборудовании, процессе или материалах отсутствуют какие-либо изменения, способные ухудшить процесс стерилизации. Если такие изменения проводят в плановом порядке, то новый цикл стерилизации должен быть валидирован. При нарушениях в процессе, которые не могут быть связаны с нарушением требований технической документации, следует рассмотреть необходимость валидации.
8.3 Периодическая проверка
Следует проводить плановую периодическую проверку стерилизаторов.
8.4 Оценка эффективности цикла
Эффективность процесса в цикле стерилизации оценивают по установленным физическим параметрам.
Примечание - Текущий отбор проб (испытание на стерильность) или использование биологических индикаторов не рекомендуется, за исключением специальных случаев. Эти испытания имеют ограниченную ценность в текущем контроле процесса стерилизации влажным теплом и всегда должны рассматриваться совместно с достижением физических параметров.
8.5 Выгрузка стерилизованных продуктов
8.5.1 Необходимо предусмотреть систему разделения стерилизованных и нестерилизованных образцов.
8.5.2 Порядок выгрузки продукта после стерилизации должен гарантировать, что параметры валидированного процесса стерилизации воспроизводились внутри установленных пределов. Каждая выгрузка должна быть документирована с указанием фамилии лица, принявшего решение о выгрузке.
8.5.3 Для каждой загрузки в протокол выдачи (выгрузки) следует включать:
a) характеристику загрузки или ссылку на техническую документацию загрузки;
b) записи текущего испытания;
c) записи цикла стерилизации.
8.5.4 С продуктами, не отвечающими требованиям, необходимо поступать в соответствии с требованиями ГОСТ Р ИСО 9001 или ГОСТ Р ИСО 9002.
8.6 Проверка операций
Контроль качества продукции и процесса производства и все протоколы должны рассматриваться не реже одного раза в 12 мес. Компетентный персонал, прямо не участвующий в этих процедурах, должен гарантировать, что производственные инструкции и данные, полученные во время валидации, действуют и выполняются.
8.7 Корректирующие действия
Процедуры и документация для корректирующих действий должны соответствовать требованиям ГОСТ Р ИСО 9001. Любые отклонения от документации и инструкций, вскрытые во время операций, проверок, калибровки или обслуживания, должны быть рассмотрены лицом, уполномоченным определять надлежащие шаги и корректирующие действия. Любые принятые корректирующие действия должны быть документированы.
8.8 Протоколы
Протоколы, фиксирующие, что продукт стерилизован в соответствии со спецификациями, должны оформляться и поддерживаться, как это указано в ГОСТ Р ИСО 9001 и ИСО 13485 или ГОСТ Р ИСО 9002 и ИСО 13488.
ПРИЛОЖЕНИЕ А (справочное). Руководство по валидации и текущему контролю стерилизации влажным теплом в медицинских учреждениях
ПРИЛОЖЕНИЕ А
(справочное)
А.1 Область применения
Не дается указаний к разделу 1.
А.2 Нормативная база
Не дается указаний к разделу 2.
А.3 Определения
Не дается указаний к разделу 3.
А.4 Общие положения
Этот раздел содержит руководство по аттестации персонала, подготовке и обучению, правилам сохранения здоровья персонала, личной гигиене и одежде. Здесь содержатся основные рекомендации по минимизации бионагрузки, содержащей загрязнения, и обеспечивающие эффективность процесса стерилизации.
А.4.1 Требования к персоналу
Наблюдение за процессом. Лица, ответственные за стерилизацию в медицинских учреждениях, должны быть аттестованы с учетом их подготовки и опыта работы. Они должны отвечать за выбор методов, организацию всех этапов стерилизации, правильное расходование средств, а также обеспечить подготовку своих служащих на централизованной основе. Обучение на рабочем месте должно проводиться на оборудовании на основе инструкций, используемых на предприятии. В документации об образовании и обучении должен регистрироваться персональный уровень знаний по всем этапам процесса.
Образование, обучение и уровень знаний должны контролироваться и документироваться по следующим вопросам:
a) безопасность при обращении с контаминированными предметами;
b) деконтаминация и очистка;
c) проверка;
d) подготовка и комплектация;
e) упаковка/обертка;
g) загрузка стерилизатора;
h) контроль цикла;
i) правильное обращение после стерилизации;
j) хранение;
k) выгрузка;
l) документация процесса;
m) гарантия качества.
Ответственное лицо должно обеспечить проведение инструктажа и обратную связь для исправления ошибок и проверки соответствия принятой концепции и инструкциям.
Контролирующий персонал. Вся деятельность по подготовке и стерилизации, включая деконтаминацию, проверку, упаковку, стерилизацию, хранение и выдачу, должна подвергаться контролю. Персонал, предназначенный для выполнения контрольных функций, должен быть профессионально подготовлен к выполнению ответственных обязанностей. Стерилизация влажным теплом является процессом, который должен контролироваться персоналом, имеющим большой опыт работы в здравоохранении в части контроля стерилизации, процесса обработки и контроля инфекции. Персонал должен принимать участие в программах повышения квалификации и занятиях на курсах, которые включают знакомство с правительственными документами, управление персоналом и материальными ресурсами, так же, как и непосредственно процесс стерилизации.
Охрана здоровья и личная гигиена. Должны быть разработаны и доведены до персонала инструкции по личной гигиене, определены режимы мытья и обработки рук. Повышенное внимание к личной гигиене снижает риск перекрестной инфекции. Должны быть разработаны инструкции по составлению отчетов о лечении и о местонахождении служащих, которые могут быть источником инфекции или которые склонны к риску инфекционных заболеваний.
Персонал должен осознавать различные виды риска для здоровья, связанные с выполнением специфических задач. Должны быть разработаны и документально оформлены инструкции по снижению до минимума этого риска.
А.4.2 Одежда
Соответствующая одежда сводит к минимуму попадание микроорганизмов от персонала на стерилизуемые предметы. Персонал, занятый подготовкой, стерилизацией и хранением в стерильных помещениях, должен носить чистую одежду, которую следует менять не реже одного раза в день. Контролируемая стирка одежды уменьшает риск распространения микроорганизмов. Должны быть разработаны инструкции, гарантирующие, что эти рекомендации выполняются.
Для определения типа одежды необходимо учитывать:
a) вероятность загрязнения в процессе работы;
b) вероятность перекрестной контаминации между помещениями;
c) периодичность смены одежды.
Особое внимание должно уделяться одежде, которую персонал носит в помещениях деконтаминации и упаковки. В помещениях для деконтаминации одежда должна выбираться, исходя из необходимости снижения риска загрязнения микроорганизмами персонала во время работы. В помещениях для упаковки одежду выбирают из расчета снижения загрязнения частицами изделий, подлежащих обработке.
А.4.3 Учет особенностей продукции
Необходимо принимать во внимание рекомендации изготовителя медицинской продукции по повторной обработке, а также ее совместимости с процессами, специфичными для данного оборудования. Когда изготовитель указывает максимально допустимое число циклов обработки продукта, должна быть разработана система регистрации числа циклов обработки. Протоколы для каждого продукта должны сохраняться. По возможности деконтаминация и очистка должны проводиться в оборудовании, предназначенном для этой цели. В этой стадии процесса обработка влажным теплом предпочтительней других методов.
А.4.4 Требования к упаковке
Дальнейшая информация о требованиях к материалу упаковки дана в ИСО 11607.
Материалы, используемые для упаковки, должны быть совместимыми с содержащимся в ней продуктом. При разработке комплекса инструкций по выбору упаковочных материалов следует также учитывать:
a) прочность на разрыв;
b) допустимость асептического применения;
c) допустимый уровень токсичных веществ, медленно сохнувших красок и хлопчатобумажных волокон, не ухудшающих качество продукта;
d) отсутствие выделения любых газов, ограничивающих удаление воздуха и проникание пара.
А.5 Оборудование
Примечание - При выборе конструкции оборудования или процессов стерилизации отдается предпочтение нормативным документам страны пользователя.
А.5.1 Документация
А.5.1.1 Данные об оборудовании
Не даются.
А.5.1.2 Безопасность
Следует иметь письменные инструкции для предупреждения пользователя о потенциальной опасности, связанной с эксплуатацией оборудования. Эти материалы должны быть описаны в документах, прилагаемых к оборудованию (ГОСТ Р 51350 и ГОСТ Р МЭК 61010-2-041).
А.5.1.3 Руководства и инструкции
Информация по валидации программного обеспечения см. [1].
А.5.1.4 Дополнительная информация
Не рассматривается.
А.5.2 Эксплуатационные характеристики стерилизатора, технологические среды и источники энергии, материалы, принадлежности и средства контроля
А.5.2.1 Эксплуатационные характеристики
Доказательство того, что стерилизатор соответствует своим техническим требованиям, может быть получено от изготовителя, установлено пользователем или получено от третьей стороны.
А.5.2.2 Технологические среды и источники энергии
А.5.2.2.1 Стерилизатор должен быть предназначен для работы с насыщенным паром или предварительно подготовленной паровоздушной смесью. При использовании пара сухость его должна быть не менее 95%, а объемная доля неконденсированных газов не более 3,5%. Перегрев не должен превышать 5 °С. Гарантия непрерывного контроля качества пара обеспечивается контролем конденсата. Конденсат не должен содержать контаминантов в количестве, которое может ухудшить процесс стерилизации, повредить стерилизатор или нарушить целостность продукта. Флуктуации давления пара перед редуктором не должны превышать 10% и коэффициент редукции должен быть не более 2:1. Для удаления конденсата и неконденсирующихся газов из пара, подаваемого в стерилизатор, должны быть предусмотрены ловушки для пара и воздуха. От изготовителя необходимо получить информацию о допустимых параметрах воздействия факторов стерилизации на продукт.
А.5.2.2.2 Стерилизатор должен быть предназначен для работы со сжатым воздухом, свободным от капельной влаги, профильтрованным до 5 мкм и содержащим не более 0,5 мг/м масла в нормальном воздухе. Сжатый воздух должен проходить через микробиологический фильтр, находящийся в точке потребления. Фильтр должен задерживать частицы размером более 0,3 мкм с эффективностью не менее 99,5%.
А.5.2.2.3 Для стерилизаторов, требующих подачи воздуха в камеру непосредственно из атмосферы, воздух должен проходить очистку через фильтр с эффективностью не менее 99,5% по частицам размером более 0,3 мкм.
Для герметичных продуктов не требуется проводить микробиологическую фильтрацию подаваемого воздуха в камеру. Проницаемая упаковка при вакуумировании, нагреве и наличии влажности может привести к прониканию микроорганизмов, которое при нормальных условиях не наблюдается. Нормальная герметичная упаковка может стать проницаемой, если имеет место выделение компонентов, вызванное прониканием тепла и/или внутренним вакуумом, причиной которого является охлаждение воздуха внутри продукта.
А.5.2.2.4 Вода для образования пара и вода для прямого охлаждения не должна содержать контаминантов в концентрации, способной ухудшить условия процесса стерилизации, нанести вред стерилизатору, стерилизуемому продукту или создать любую другую опасность для здоровья (таблица А.1). Вода для вакуумных систем должна быть кипяченой, подаваться при температуре, соответствующей эксплуатационным характеристикам стерилизатора (например, около 15 °С). Жесткость ее должна быть меньше или равна 0,2 ммоль/л, а рН не менее 6,5.
Таблица А.1 - Типовые пределы концентрации загрязнений в паре и/или воде, контактирующих с продукцией и/или ее упаковкой
| Загрязнитель | Пределы |
| Остатки парообразных веществ |
|
| Кремний |
|
| Железо |
|
| Кадмий |
|
| Свинец |
|
| Остатки тяжелых металлов |
|
| Хлор |
|
| Фосфаты |
|
| Электропроводность |
|
| рН | От 6,5 до 8 |
| Видимые свойства | Бесцветность, прозрачность, отсутствие осадка |
| Жесткость |
|
Протоколы контроля должны быть представлены в письменной форме.
Периодичность испытаний должна быть такой, чтобы своевременно выявлять изменение параметров и не допускать превышения пределов, указанных в таблице А.1.
Должны быть предприняты меры по предотвращению попадания в парогенератор любых примесей (например, остатков микробиологических загрязнений). Это может быть выполнено, например, с помощью контроля контаминации питающей воды или системы удаления примесей из парогенератора.
А.5.2.2.5 Электрическое питание, подводимое к стерилизатору, должно обеспечивать надлежащую и надежную работу системы. Электрическое питание, подводимое к стерилизатору, должно быть выполнено в соответствии с нормами. Качество электрического питания и непрерывное электроснабжение для систем контроля и измерения процесса стерилизации может быть достигнуто за счет надежного подвода необходимого напряжения.
А.5.2.3 Системы трубопроводов и теплообменники
При проектировании трубопроводов следует учитывать необходимость дренажа и, когда это нужно, стерилизацию трубопроводов. Дополнительные требования включают ликвидацию мертвых зон, необходимость соблюдения соответствующих уклонов, применения других компонентов систем и любых других мер, необходимых для минимизации застаивания воды и микробного роста. Качество соединений должно предотвращать утечку. Линии не должны напрямую соединяться со сточными системами без разрыва струи через атмосферу, чтобы избежать обратного сифонирования. Внутренние соединения между водяными охлаждающими системами и другими системами, такими как системы сжатого воздуха, должны быть рассчитаны на предотвращение противотока. Для насосов, перекачивающих охлаждающую воду и требующих смазки уплотнений, следует применять воду, качество которой соответствует качеству перекачиваемой воды. Теплообменники должны быть рассчитаны так, чтобы предотвращалась утечка внешней среды в циркуляционную систему. Если процесс стерилизации требует контроля уровня воды, то должно предусматриваться использование соответствующих уровнемеров и систем сигнализации допустимого уровня.
Отверстия в трубопроводах для систем контроля и тестирования должны быть соответствующего размера, в достаточном количестве и располагаться надлежащим образом. Должны быть предусмотрены предохранительные клапаны, которые должны располагаться так, чтобы они не могли быть блокированы. Назначение всех отверстий должно быть четко определено.
А.5.2.4 Принадлежности
Не дается указаний к 5.2.4.
А.5.2.5 Системы контроля и регистрации
А.5.2.5.1 Температуру в камере измеряют термодатчиком, расположенном в наименее прогреваемой точке рабочего пространства камеры. Обычно применяют термометры сопротивления или термопарные датчики.
При стерилизации насыщенным паром контролируемая в камере температура должна соответствовать давлению в камере.
Измерительная и регистрирующая системы могут использовать аналоговые или цифровые данные. Эта система может быть использована вместе с данными ручной регистрации для документирования следующих параметров и результатов процесса:
a) дата;
b) тип стерилизатора и заводской номер;
c) наименование и регистрационный номер загрузки (например, серия или номер цикла);
d) наименование регистрируемого цикла, если используется более одного программируемого цикла;
e) фамилия и подпись оператора;
f) время начала цикла (реальное время);
g) давление в камере в зависимости от текущего времени;
h) температура в камере в зависимости от текущего времени;
i) начало фазы выдерживания;
j) окончание фазы выдерживания;
k) время охлаждения, конечная температура или то и другое.
Системы контроля включают устройства для регистрации времени, температуры и давления, а также измерительные приборы. Когда предусмотрена регистрация времени, температуры и давления в системе контроля, оператор в начале цикла должен убедиться, что в записи отмечены дата, регистрационный номер стерилизатора и его фамилия. По окончании цикла и перед передачей продуктов для использования оператор должен рассмотреть запись, удостовериться, что параметры цикла достигнуты, и отметить этот факт, чтобы впоследствии можно было установить фамилию оператора, принявшего решение о выгрузке.
А.5.2.5.2 Большинство датчиков температуры измеряют температуру внутри камеры в месте разгрузки продукта из стерилизатора, но не в центре размещения упаковок. При загрузке жидкими препаратами репрезентативное размещение датчиков будет иметь место внутри контейнеров, содержащих жидкость одинаковой вязкости и имеющих сходные размеры и форму. Ненадлежащая конфигурация загрузки или упаковка могут препятствовать удалению воздуха или прониканию пара; эти условия не могут быть зафиксированы регистрацией температуры. Поэтому механический мониторинг и другие средства индикации работы стерилизатора никогда не могут рассматриваться в качестве замены тщательного и строгого соблюдения правил валидированных процедур упаковки и загрузки.
А.5.2.6 Контролирующие программы
Руководство не предусмотрено.
А.5.3 Эксплуатация приборов контроля.
Способность системы стерилизации контролировать требуемые параметры процесса зависит от конструкции всей системы, технических характеристик измерительных и контролирующих приборов и калибровки.
А.5.3.1 Точность приборов
Устройство контроля температуры должно быть:
a) цифровым или аналоговым;
b) с точностью ±1% в диапазоне шкалы 50-150 °С;
c) отрегулировано с точностью ±0,5 °С от температуры стерилизации;
d) с защищенным от разрушения датчиком;
e) приспособлено для пользования ключом, кодом или инструментом без разборки прибора.
Устройство контроля давления должно быть:
a) цифровым или аналоговым;
b) с точностью не менее ±1,6% в диапазоне шкалы от 0 до 5 бар абсолютного давления (от 0 до 500 кПа);
c) с защищенным от разрушения датчиком;
d) приспособлено для использования ключом, кода или инструмента без разборки прибора.
Таймер должен иметь точность не менее ±1% для периодов времени более 5 мин и не менее ±2,5% для периодов времени до 5 мин.
По возможности следует вычислять систематические ошибки, которые должны корректироваться с использованием соответствующих поправочных коэффициентов.
Точность приборов для тестирования должна быть не меньше, чем точность приборов, используемых для стерилизатора, и должна превышать не менее чем в три раза точность измерений, необходимых для заключения о работоспособности стерилизатора.
А.5.3.2 Калибровочные эталоны
Не дается указаний к 5.3.2.
А.5.3.3 Калибровочные программы
Не дается указаний к 5.3.3.
А.5.4 Техническое обслуживание
А.5.4.1 Стерилизаторы необходимо осматривать и очищать согласно инструкциям изготовителя. Примерами элементов, требующих особого внимания, являются самописцы, прокладки дверей, дренажная решетка в камере, внутренние поверхности камеры и наружные поверхности стерилизатора. Плановые осмотры и очистку следует проводить в соответствии с письменными инструкциями изготовителя.
Периодический осмотр и очистка уменьшают вероятность неисправной работы. Чистота поверхностей, находящихся в помещениях загрузки и разгрузки, снижает риск случайной контаминации стерильного материала.
А.5.4.2 Лицо, осуществляющее техническое обслуживание оборудования в соответствии с письменными инструкциями изготовителя, должно быть обучено этому. Особое внимание должно быть уделено обслуживанию и замене изнашивающихся элементов. Примерами этого могут служить самописцы (если необходимо), фильтры, паровые ловушки, трубопроводы дренажа, вентили и уплотнения дверей.
А.5.4.3 Смазку соответствующих частей и замену расходуемых частей, таких как паровые ловушки, должен проводить квалифицированный персонал. Некоторые задачи могут потребовать сервисного обслуживания изготовителем или другой квалифицированной сервисной организацией. Периодичность обслуживания может зависеть от того, как часто используется оборудование, и может варьироваться в зависимости от вида оборудования; для руководства должны использоваться инструкции изготовителя.
А.5.4.4 Не дается указаний к 5.4.4.
А.5.4.5 Обслуживание каждого стерилизатора необходимо документировать. Лицо, выполняющее обслуживание, должно регистрировать в журнале каждую операцию. Журнал регистрации должен храниться в месте расположения стерилизатора. Включенные в него записи должны содержать достаточную информацию для указания на конкретный вид парового стерилизатора и определения непрерывной истории обо всех запланированных и незапланированных работах по обслуживанию.
А.5.4.6 Не дается указаний к 5.4.6.
А.6 Разработка процесса стерилизации
Примечание - См. также приложение В.
А.6.1 Медицинская продукция, которая подвергается стерилизации влажным теплом в медицинских учреждениях, может быть приобретена у поставщика или изготовлена в самом медицинском учреждении. Для приобретаемой у поставщика продукции должна быть получена следующая информация:
- допустимость стерилизации влажным теплом;
- максимальная температура стерилизации;
- пределы давления и/или вакуума, включая скорости изменения;
- рекомендации по очистке, если необходимо, включая разборку (если требуется), средства и приспособления для очистки;
- инструкции по разборке изделий для стерилизации, если требуется;
- допустимое количество повторных циклов, если существует опасность снижения качества продукта.
При разработке и производстве продукта в самом медицинском учреждении должна быть подготовлена такая же информация.
Эффективная стерилизация медицинской продукции включает много дополнительных требований к самому циклу стерилизации:
Очистка. Очисткой удаляют все видимые загрязнения и смазку с поверхности продукта и всех внутренних полостей (например, зонды или катетеры). Процесс очистки должен включать и поверхности с невидимой контаминацией, чтобы снизить количество окружающих микроорганизмов. Особое внимание должно быть уделено катетерам, чтобы обеспечить адекватную очистку и удаление чистящих растворов. Все поверхности следует ополаскивать и высушивать.
Примечание - В процессах очистки может возникнуть необходимость разъединить продукт, состоящий из множества частей, чтобы обеспечить эффективное удаление загрязнений.
Осмотр. После очистки компоненты продукта, если возможно, и собранный продукт должны быть осмотрены. Продукт должен быть чистым и не иметь повреждений, которые могут повлиять на безопасность и функцию продукта.
Сборка. После осмотра продукты должны быть скомплектованы в том виде, в котором они могут стерилизоваться. Это может означать группировку нескольких предметов в один комплект. Для обеспечения эффективной стерилизации в зависимости от конкретного процесса стерилизации влажным теплом некоторые продукты могут потребовать разъединения.
При разработке процедур осмотра и сборки необходимо свести к минимуму контаминацию продукта физическими, химическими и микробиологическими загрязнителями.
Перед сборкой и стерилизацией пористые материалы должны быть выдержаны в окружающей среде с относительной влажностью от 35 до 70% при комнатной температуре. Температурное и влажностное равновесие упаковочного материала и продукта с окружающей средой облегчает удаление воздуха, проникание стерилизующего агента (влажного тепла) и уменьшает вероятность перегрева.
Упаковка (4.4 и А.4.4). Продукты должны быть упакованы немедленно после завершения процедуры сборки. Хранение и транспортирование к стерилизатору не должны приводить к повреждению упаковки. Время хранения перед стерилизацией должно быть минимальным. Хранение должно проводиться при температуре и влажности, указанных выше.
Загрузка. Содержание и конфигурацию загрузки продукта в камеру следует оформлять документально. Если разрешена загрузка продукта только одного типа, диаграмма загрузки и максимальная/минимальная загрузка также должны быть документированы. При смешанной загрузке приемлемая комбинация продуктов и конфигурация загрузки должны быть определены и документированы. Факторы, которые могут влиять на смешивание продуктов в загрузке, включают способность выдерживать условия процесса стерилизации; размер и вес упакованного продукта; конфигурацию упакованного продукта и способность пара проникать в упаковку и продукт.
Загрузка продукта должна обеспечивать условия контакта стерилизующего агента с каждой стерилизуемой поверхностью.
Примечание - Продукты для загрузки в стерилизатор группируют по сходству их размеров, формы, веса, комплектующих материалов и, для изделий с катетерами и трубками, по соотношению длины и диаметра.
Выдерживание при условиях стерилизации. Выбор типа цикла стерилизации зависит от конфигурации продукта и способности продукта и упаковки выдерживать воздействие температур, давления и общего теплопритока.
Стерилизация влажным теплом медицинской продукции может быть осложнена неоднородностью типов продуктов, упаковки продуктов и конфигурации загружаемых сосудов, которые могут мешать друг другу при укладке. Факторы, которые могут влиять на стерилизацию влажным теплом медицинской продукции, приведены в таблице А.2.
Таблица А.2 - Факторы, которые при стерилизации влажным теплом могут влиять на устройства и компоненты или повредить их
| Объекты или процесс | Факторы | Пояснения |
| Упаковка | Плотность, единицы объема | Проникание пара, способность высушиваться перед окончанием цикла, надежность герметизации, задержка влаги или конденсация, поддержание стерильности и сохранение маркировки во время процесса |
| Устройство или компонент | Структура, сложность, расчет | Абсорбция влаги, термическая деградация, возможность проветривания с удалением воздуха, проникания влаги, последующего высушивания; поддержание уровня стерильности и возможная утрата функции |
| Загрузка стерилизатора | Масса стерилизатора (например, при полной или частичной загрузке) | Скорость проникания пара, надежность проникания влаги и скорость высушивания после стерилизации |
Многокомпонентные продукты могут содержать поверхности, недоступные для проникания пара, необходимого для стерилизации. В таких случаях может оказаться необходимым разъединить продукт для стерилизации. В крайних случаях, может возникнуть необходимость демонстрации того, что стерилизация возможна, с помощью микробиологических тестов (см. ИСО 11737-2*).
________________
* До введения в действие оригинал стандарта - во ВНИИКИ Госстандарта России.
Если упакованные продукты подлежат стерилизации влажным теплом, нужно обратить внимание на эффективное высушивание упаковочного материала после стерилизации и упакованного содержимого, чтобы сохранить защитные свойства упаковки.
Между продуктами и упаковками, подлежащими стерилизации, может быть много сходного. Между несколькими устройствами может быть только одно различие, которое, например, заключается в незначительной модификации длины трубок или в наличии некоторых принадлежностей, которые не влияют на пригодность продуктов к стерилизации. Многие упаковки продуктов могут состоять из одного и того же материала с небольшими различиями в размерах. Основной подход состоит в классификации продуктов и упаковок по их сходству и последующей оценке условий внутри данной классификации, которые создают наибольшие трудности. Указанные группы продуктов и упаковок могут быть использованы при разработке циклов стерилизации, сертификации методов валидации стерилизаторов и разработке других методов обеспечения качества и тестирования продуктов. Методы изучения или объяснение того, почему продукт отнесен к конкретной классификации, должны быть документированы.
Определение наиболее трудной для стерилизации поверхности обычно может быть достигнуто с помощью термодатчиков (например, термопар). Они должны быть расположены в трудных, с точки зрения нагрева, местах размещения продукта и подвергнуты воздействию стерилизации влажным теплом. Наиболее типичные в этом отношении пространства - это длинные трубки, узкие катетеры, мертвые пространства на концах, центры пористых загрузок, также как внутренние места больших масс продуктов.
Математические и графические методы, разработанные с учетом летальности для термочувствительных продуктов (часто выражаемые через физический критерий ), могут использоваться на основе данных температуры продукта. Расчет величины
на основе физических параметров процесса приведен в публикациях Американской национальной консервной ассоциации [2-4]. Эти методы позволяют ввести в расчет микробиологической летальности фазы нагрева и охлаждения цикла. При использовании этой техники необходимо учитывать и другие факторы, такие как воспроизводимость окружающей продукт среды и точность приборов. Это может потребовать дополнительных исследований.
Разгрузка. Процедура разгрузки должна быть разработана так, чтобы избежать повреждения упаковки. При завершении цикла стерилизации предметы в загрузке могут еще содержать пар, который может конденсироваться, если предметы имеют контакт с холодной поверхностью. Загрузка должна подвергаться немедленному осмотру без прикосновения к предметам после открывания стерилизатора. Если при использовании пористой упаковки продукт оказывается влажным, то загрузка должна быть отсортирована. Загрузка стерилизатора должна быть извлечена из камеры и перед тем как ее использовать, оставлена для дальнейшего остывания и осушки. Равновесная влажность и температура достигаются в помещении, в котором отсутствуют сквозняки и ограничено движение людей. Горячие и влажные материалы более подвержены повреждению. По завершению периода выравнивания температуры и влажности и перед направлением загрузки для хранения последняя должна быть еще раз проверена на наличие признаков влаги.
Особого внимания требуют жидкости в герметичных контейнерах. Эти продукты могут быть причиной серьезных последствий для здоровья, если не принять соответствующие меры сразу после стерилизации. Их нельзя удалять из камеры, пока температура жидкости не станет ниже температуры точки кипения (т.е. на 20 °С ниже для жидкостей в стеклянных контейнерах и на 10 °С ниже для жидкостей в пластиковых контейнерах, например, в ПХВ). См. для дополнительного руководства ГОСТ Р МЭК 61010-2-041.
Хранение и реализация. Стерилизованную продукцию не следует хранить в помещениях, подверженных значительным колебаниям влажности, давления и/или температуры. Системы транспортирования и распределения должны быть выполнены так, чтобы избежать повреждения упаковки. Там, где это необходимо, на упаковке должен быть проставлен срок годности и предусмотрена система, обеспечивающая очередность использования в зависимости от времени выпуска продукции.
А.6.2 Не дается указаний к 6.2.
А.6.3 Исследование разрабатываемого цикла может быть проведено в исследовательском сосуде, если показана эквивалентность его с сосудом, в котором находится продукт.
Процессы стерилизации влажным теплом должны быть разработаны для наиболее узкого практического диапазона температур в стерилизационной камере. Процессы с предварительным вакуумированием насыщенного пара являются более легкими для контроля, в то время как, например, цикл с использованием паровоздушной смеси или воды под давлением сопровождается более широким диапазоном температур, и поэтому контролировать его более сложно. Процесс валидации, заключающийся в проведении определенного числа повторяющихся циклов, может служить надежной базой для демонстрации адекватности желаемого контроля. В течение установленного времени температура в камере:
a) не должна превышать более чем ±3 °С нижний предел температуры стерилизации;
b) не должна колебаться более чем на ±1 °С;
c) не должна отличаться одна от другой более чем на 2 °С.
Создание атмосферы насыщенного пара продувкой воздухом или использованием гравитационного перемещения воздуха приводит к некоторой неопределенности при создании однокомпонентной (т.е. паровой) атмосферы. Удаление воздуха из пористых материалов и таких ловушек воздуха, как катетеры, представляет большие трудности. Структура загрузки камеры стерилизатора является критической как с точки зрения обеспечения удаления воздуха из упаковки и продукта, так и адекватного проникания пара. Для таких циклов могут потребоваться дополнительные валидационные испытания.
Сохранение целостности упаковки при стерилизации влажным теплом герметичных контейнеров с жидкостями и газами может потребовать внешнего давления, большего, чем при простом нагреве. Если содержащаяся в контейнере жидкость является водой (или раствором со сходными физическими свойствами), то давление пара, создаваемого в фазах подогрева и выдержки, не может превышать давление теплоносителя. Для предотвращения возникновения избыточного давления внутри контейнеров по сравнению с давлением в камере, в последнюю подается сжатый воздух. В результате суммарное давление паровоздушной смеси в камере препятствует разрушению контейнеров (стекло, пластик) в фазах подогрева и выдержки.
Следует обеспечить эффективное смешение воздуха и пара. Обычно это достигается с помощью вентилятора. Необходимо, чтобы и конфигурация загрузки обеспечивала свободную циркуляцию между упаковками.
Повышенное давление в камере может создаваться за счет распыления воды под давлением. При этом проблема равномерного перемешивания воды и пара отсутствует. Однако принудительная циркуляция такой смеси необходима. Этот способ повышения давления в камере требует дополнительного расхода воды, которая должна быть стерильной, апирогенной и химически нейтральной.
А.6.4 Полученные температурные данные процесса стерилизации используются для вычисления величин, характеризующих наименьшую летальность процесса, например, при минимальной температуре и времени воздействия.
В это исследование может быть включено изучение других факторов, которые могут оказать влияние на летальность процесса. К ним относятся колебания начальной температуры продукта, температуры камеры/рубашки, продолжительности нагрева и охлаждения, конфигурация загрузки и т.д.
А.6.5 Циклы стерилизации в учреждениях здравоохранения должны выбираться на основе известных соотношений время/температура, которые получены при избыточном процессе стерилизации. Примеры фазы выдерживания при общепринятых циклах стерилизации:
- 134 °С - при минимальном времени выдерживания 3 мин;
- 121 °С - при минимальном времени выдерживания 15 мин.
В исключительных случаях могут применяться циклы стерилизации, иные чем общепризнанные в научной и технической литературе соотношения время/температура, при этом они нуждаются в дополнительном обосновании.
В приведенных выше режимах стерилизации не учитывается стерилизующий эффект в период нагрева и охлаждения продукта. Для термолабильных продуктов, которые не могут выдержать воздействие общепризнанного режима стерилизации, применение метода расчета величины может помочь обосновать снижение температурно-временного воздействия и обеспечить переход к более мягкому режиму стерилизации.
Вычисление величины для характеристики цикла летальности проводится при температуре 121 °С и величине
10 °С. Данные о температуре продукта в течение всего процесса (нагревание, выдержка, охлаждение) преобразуются для вычисления эквивалентной летальности при температуре 121 °С и математически или графически интегрируются для получения физической величины летальности, выражаемой в минутах, эквивалентных выдержке при температуре 121 °С. Например, каждая минута при 114 °С имеет скорость отмирания, эквивалентную 0,2 мин при 121 °С, если
10 °С. Некоторые программы позволяют рассчитывать величину
всего процесса стерилизации непрерывно, используя данные от одного или более датчиков температуры, размещенных в продукте.
Температурные датчики, используемые для текущего контроля любого цикла стерилизации влажным теплом, должны располагаться в самых слабых, с точки зрения достижения условий стерилизации, местах внутри загрузки и камеры. Обоснование расположения датчиков должно быть оформлено документально. Если такие слабые места неизвестны, тогда для определения этих мест в пустой камере, загруженной камере и внутри загрузки должны быть проведены исследования распределения температуры. Для подтверждения воспроизводимости должны быть проведены повторные циклы. Если размер упаковки или контейнера или наполняемый объем малы, то нужно обратить внимание на возможные эффекты теплопередачи вдоль температурного зонда и внутри продукта или на необходимость введения зонда на нужную глубину, чтобы минимизировать ошибки теплопередачи от пара. Чтобы свести к минимуму эффект нагрева, можно использовать малогабаритный проволочный датчик.
Расчет процесса стерилизации включает следующие этапы:
- выбор подходящего цикла (см. приложение В) для стерилизуемого продукта;
- определение наиболее трудных для стерилизации мест в продукте;
- определения требований к деконтаминации, очистке, упаковке и т.д.;
- определение возможности отнесения продукта к существующей группе продуктов и существующего цикла стерилизации;
- определение эффективности цикла стерилизации путем измерения температуры и, если это целесообразно, то испытанием с помощью микробиологических индикаторов.
А.6.6 Стерилизация влажным теплом есть вероятностная функция тепловой энергии, времени, содержания влаги, числа микроорганизмов, связанных с продуктом (бионагрузки) и терморезистентности этих микроорганизмов. Типовые циклы, приведенные в А.6.5, являются общепринятыми, основанными на истории резистентности "типовой" бионагрузки микроорганизмов и учитывающие, что подготовка продукта (например, очистка) снижает число микроорганизмов.
Любое проведенное микробиологическое тестирование должно соответствовать ГОСТ Р ИСО 11138 и ГОСТ Р ИСО 11737-1.
А.6.7 Не дается указаний к 6.7.
А.7 Валидация
Валидация является общим процессом, состоящим из комиссионной проверки и проведения аттестации в эксплуатации. Соотношение между этими понятиями показано ниже:

А.7.1 Валидация выполняется для того, чтобы оценить надежность процесса стерилизации. В протоколе валидации указывается, что, когда и как нужно измерять. Форма записи данных в протоколе должна облегчить последующую интерпретацию результатов. Требования, по которым будут судить об эффективности процесса стерилизации, должны быть сформулированы и зафиксированы перед валидацией. Ясную и объективную валидацию гарантирует выполнение требований системы контроля качества, например, ГОСТ Р ИСО 9002.
Особое внимание должно быть уделено физическим параметрам на протяжении всего цикла стерилизации (а не только фазы выдерживания), чтобы они значительно не отличались от параметров разработанного цикла. Совершенствование физических условий в каждой фазе может привести к существенному повышению летальности в загрузке. Подобным же образом эффективность последующих загрузок будет зависеть от постоянства фаз охлаждения и сушки.
А.7.2 Анализ данных, полученных при валидации, покажет, что указанный цикл стерилизации в конкретном стерилизаторе будет или не будет обеспечивать стерильность указанной загрузки. Валидация, таким образом, касается не только стерилизатора, но также и таких факторов, как загрузка и ее размещение. Валидация должна повторяться всякий раз, когда проведены значительные изменения. Примерами таких изменений являются:
a) изменения в цикле стерилизации;
b) изменения в концепции упаковки или загрузки;
c) изменения в материале, подлежащем стерилизации, такие как замена 100% хлопка тканью из 50% хлопка/50% полиэфира, или
d) добавление нового комплекса медицинских изделий, подлежащих стерилизации.
Установка нового стерилизатора является важным изменением, даже если он имеет тот же тип, что и прежний. Данные, полученные от одного стерилизатора, никогда не могут использоваться для демонстрации фактических технических характеристик другого стерилизатора.
Небольшие изменения во времени в конечном счете приводят к большим изменениям. Износ и повреждение самого стерилизатора, естественно, представляют собой серьезные изменения в системе стерилизации. По этим причинам рекомендуется периодическая валидация (например, один раз в 12 мес).
А.7.3 Не дается указаний к 7.3.
А.7.4 Комиссия должна оценить соответствие стерилизатора и связанных с ним обслуживающих устройств спецификациям и техническим характеристикам, безопасность стерилизатора и пригодность его для использования.
А.7.5 Аттестация стерилизатора должна показать, что стерилизатор действительно способен стерилизовать загрузку. Так как загрузка в значительной степени влияет на процесс стерилизации, необходимо оценить диапазон возможного применения стерилизатора при использовании различных загрузок и их модификаций. В связи с этим следует подчеркнуть, что некоторые загрузки и формы загрузки нельзя стерилизовать методом стерилизации влажным теплом.
Стерилизуемость однородных загрузок будет легче оценить и соответственно уменьшить объем работы по валидации. Смешанные загрузки (например, комбинация текстильных материалов и инструментов) могут потребовать проведения дополнительных испытаний, чтобы удостовериться в том, что соответствующая комбинация будет пригодна для стерилизации.
Аттестация стерилизатора должна проводиться на основе протоколов загрузок.
Так как работоспособность стерилизатора устанавливается с помощью измерения физических параметров, необходимо документировать влияние этих параметров на величину микробиологической летальности.
При стерилизации насыщенным паром имеет место избыток данных, пригодных для оценки результатов внутри заданных пределов. Обычно для расчета берут максимальную разницу температур между двумя различными точками в фазе стерилизации, не превышающую 2 °С. Учитывая требование, что температура насыщенного пара, соотносимая с давлением, измеренным в фазе стерилизации, должна находиться в тех же пределах 2 °С в течение менее 15 с, можно показать, что в стерилизаторе существует атмосфера насыщенного пара и, таким образом, избежать больших дополнительных исследований.
А.7.6 Однородность загрузки и форма загрузки главным образом определяют количество необходимых датчиков температуры. Практика показывает, что из пяти или более датчиков, находящихся в камере объемом 100 л, как правило, бывает достаточно показаний одного датчика, чтобы адекватно оценить цикл стерилизации. При применении паровоздушных смесей и/или смешанных загрузок может потребоваться большее количество датчиков. По крайней мере, один датчик должен располагаться возле датчиков контроля и мониторинга, один в свободном пространстве камеры, и, по крайней мере, один должен располагаться на непрогреваемой части стенки камеры. Последний датчик используют для определения влияния рубашки на загрузку (например, для оценки влажных загрузок).
А.7.7 Качество процесса валидации зависит от точности и надежности измеряемой температуры и давления. Важно, чтобы была проведена хорошая калибровка в соответствии с протоколом, составляемым на оборудование. Калибровка всегда должна опираться на национальный стандарт. Недопустимо, чтобы при валидации измерения проводились в несколько приемов, чередующихся с производством уже валидированных загрузок.
А.7.8 Надежная интерпретация результатов возможна только при условии, что критерии определены до проведения валидации. Адаптация требований на базе результатов валидации находится в противоречии с некоторыми характеристиками или принципами систем. Если процесс стерилизации не находится в предварительно установленных пределах, необходимо проведение испытаний и экспертизы для интерпретации полученных результатов и для идентификации проблем, вызвавших такое несоответствие.
А.7.9 Периодическая валидация (например, каждые 12 мес) рекомендуется для того, чтобы быть уверенными, что неотмеченные изменения - вынужденные или случайные - не остались незамеченными.
А.8 Текущая стерилизация влажным теплом
А.8.1 Основа мониторинга процесса стерилизации влажным теплом - это измерение физических параметров, т.е. времени, температуры и давления. Ежедневные текущие записи этих физических параметров должны сравниваться с величинами, полученными при валидации. Воспроизводимость цикла может быть определена при условии, что приборы, используемые для измерения, точны и подвергаются регулярной калибровке.
А.8.1.2 Не дается указаний к 8.1.2.
А.8.1.3 Эти данные необходимы для определения момента, когда продукт может быть выгружен. Следовательно, должно быть назначено лицо, принимающее решение о выгрузке продукта. Для ретроспективного определения качества стерилизации продукта необходимо сохранять протоколы. Идентификация оператора должна быть однозначной, чтобы при необходимости можно было определить именно его.
А.8.2 Контроль изменений
Решение о необходимости проведения валидации или повторной валидации может быть принято только назначенным лицом, обладающим соответствующей квалификацией.
А.8.3 Периодические испытания
Для контроля наиболее общих причин отказа и адекватности результатов мониторинга должны проводиться периодические испытания (например, термометрические измерения, тесты на проникания пара, удаления воздуха и утечки вакуума). Периодичность испытаний должна устанавливаться на основе информации, поставляемой изготовителем. Например, тесты на проникание пара и удаление воздуха обычно проводятся в стерилизаторе ежедневно, в то время как совместные тесты на удаление воздуха и утечку вакуума проводятся еженедельно. Должны оцениваться не только результаты индивидуальных тестов, но также и направление изменений этих результатов. Результаты индивидуальных испытаний могут дать возможность определить отклонение от соответствующих технических требований. Оценка направления изменений результатов поможет определить ожидаемые отказы, прежде чем они могут произойти в реальном процессе.
А.8.4 Оценка цикла
Если регламент процесса не позволяет реально определить эффект контакта подлежащих стерилизации поверхностей с окружающей средой, могут быть использованы микробиологические методы. Такие случаи характерны для приборов или трубок большой протяженности.
А.8.5 Выгрузка стерилизованного продукта
А.8.5.1 Решение о выгрузке может быть принято на основании, например, контроля индикаторов в каждой упаковке, расположенных так, чтобы они были видимы снаружи упаковки, или с использованием технических систем, не позволяющих смешивать стерилизованные и нестерилизованные продукты.
А.8.5.2 Стерилизованный продукт может быть выдан (выгружен), если в документации отмечены надежное измерение и контроль всего процесса, если есть корреляция параметров процесса с гарантией стерильности, если данные мониторинга цикла стерилизации соответствуют физическим параметрам, полученным при валидации. Такое параметрическое разрешение основано на процедурах, гарантирующих отсутствие изменений в оборудовании, продукте, упаковке, или процессов, которые могут по небрежности снижать эффективность процесса стерилизации.
А.8.6 Проверка операций
Не дается указаний к 8.6.
А.8.7 Корректирующее действие
Не дается указаний к 8.7.
А.8.8 Протоколы
Не дается указаний к 8.8.
ПРИЛОЖЕНИЕ В (справочное). Циклы стерилизации
ПРИЛОЖЕНИЕ В
(справочное)
Примечание - В настоящем приложении дано описание типовых циклов, используемых при стерилизации влажным теплом. Графики служат только в качестве примеров.
В.1 Насыщенный пар - вентилируемые системы
Этот процесс стерилизации применяется для продуктов, которые выдерживают температуру при давлении насыщенного пара. В первую очередь он предназначен для поверхностной контактной стерилизации, когда удаление воздуха из материала и полостей ненадежно. Пример температурного профиля и профиля давления в камере при вентилируемом цикле стерилизации насыщенным паром приведен на рисунке В.1.
Рисунок В.1 - Пример цикла стерилизации с использованием насыщенного пара и проветривания
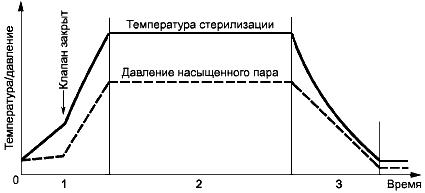
1 - нагрев; 2 - выдерживание; 3 - охлаждение
Рисунок В.1 - Пример цикла стерилизации с использованием насыщенного пара и проветривания
Процесс состоит из трех основных фаз:
а) фаза нагрева - при открытом клапане насыщенный пар подается в камеру или генерируется внутри нее до тех пор, пока не будут достигнуты желаемые условия, обычно определяемые по результатам измерения температуры. После этого клапан закрывается. И пар продолжает подаваться или генерироваться в камере до тех пор, пока не будут достигнуты заданные температура и давление пара;
b) фаза выдерживания - стерилизующая температура поддерживается в камере насыщенным паром в течение заданного времени выдерживания;
c) фаза охлаждения - эта фаза может отличаться для различных типов продукта. Для соединения камеры с атмосферой через клапан подается воздух или, если охлаждаются растворы, то в камеру подается фильтрованный сжатый воздух, чтобы предотвратить быстрый сброс давления. Эта фаза завершается тогда, когда давление в камере станет атмосферным, а в случае с герметичными контейнерами - при достижении безопасной температуры.
В.2 Насыщенный пар - принудительное удаление воздуха
Процесс предназначен для стерилизации продуктов, состоящих из пористых материалов, и/или предметов, имеющих пустоты, откуда удаление воздуха затруднено. Пример температурного профиля и профиля давления в камере приведен на рисунке В.2:
a) фаза удаления воздуха - воздух из камеры и загрузки удаляется либо с помощью глубокого вакуума, либо несколькими пульсациями вакуума, либо комбинацией пульсаций вакуума или пара;
b) фаза подачи пара - насыщенный пар подается в камеру до тех пор, пока в ней не будут достигнуты стерилизующие температура и давление;
c) фаза выдерживания - стерилизующая температура и давление поддерживаются в камере насыщенным паром в течение заданного времени выдерживания;
d) фаза выпуска пара - пар удаляется из камеры, и вакуум поддерживается на заранее установленном уровне;
e) фаза высушивания - для продуктов, которые необходимо высушивать, температура в рубашке и вакуум в камере поддерживаются на заранее установленном уровне;
f) фаза сброса вакуума - через фильтр, задерживающий микробный аэрозоль, в камеру подается воздух до достижения атмосферного давления.
Рисунок В.2 - Пример цикла стерилизации насыщенным паром с принудительным удалением воздуха
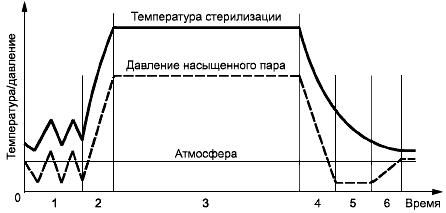
1 - удаление воздуха; 2 - подача пара; 3 - выдерживание; 4 - выпуск пара; 5 - высушивание; 6 - сброс вакуума
Рисунок В.2 - Пример цикла стерилизации насыщенным паром с принудительным удалением воздуха
В.3 Система сжатого воздуха
В.3.1 Общие положения
Некоторые продукты не могут выдержать давление пара, соответствующее температуре стерилизации. Поэтому применяют процессы с использованием сжатого воздуха, подаваемого через фильтр, задерживающий микробный аэрозоль, которые обеспечивают в течение всего цикла стерилизации или части его давление снаружи продукта, равное или превышающее давление внутри продукта.
В.3.2 Паровоздушная смесь
а) Фаза нагрева. Первая часть этой стадии такая же, как и в вентилируемых системах, исключая те случаи, когда целостность продукта может быть нарушена повышением давления пара. Тогда проветривание является помехой.
Пар продолжают подавать в камеру до достижения требуемой температуры стерилизации. Когда продукты требуют повышенного давления в этой фазе и парциальное давление попавшего в камеру воздуха недостаточно, вводится сжатый воздух. Обычно для поддержания однородности среды требуется производить перемешивание.
b) Фаза выдерживания. Стерилизующая температура в камере поддерживается насыщенным паром, и если требуется повышенное давление, подается также сжатый воздух.
c) Фаза охлаждения. Охлаждение продукта проводят охлажденным сжатым воздухом или распылением воды. Чтобы сохранить целостность продукта, следует предотвратить быстрое падение давления путем поддержания требуемого давления в камере с помощью сжатого воздуха. Давление поддерживается, пока продукт достаточно не охладится, после чего давление сбрасывается до атмосферного.
Пример температурного профиля и профиля давления в камере приведен на рисунке В.3.
Рисунок В.3 - Пример цикла стерилизации паровоздушной смесью
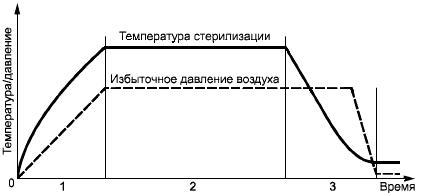
1 - нагрев; 2 - выдерживание; 3 - охлаждение
Рисунок В.3 - Пример цикла стерилизации паровоздушной смесью
В.3.3 Распыление воды
a) Фаза подачи воды. В начале цикла некоторое количество воды вводится в систему стерилизатора или используется конденсат пара. Затем вода распыляется над продуктом.
b) Фаза нагрева. Нагрев до температуры стерилизации производится либо подачей воздуха и пара в систему циркуляции, либо нагревом воды через теплообменник и вводом сжатого воздуха в камеру.
c) Фаза выдерживания. Циркуляционная система работает и температура воды поддерживается в соответствии с требованиями стерилизации в течение необходимого времени.
d) Фаза охлаждения. Давление в камере поддерживается сжатым воздухом, и продукт охлаждается снижением температуры циркулирующей воды с контролируемым расходом. В камере давление сбрасывается, когда продукт охладится до безопасной температуры.
Пример температурного профиля и профиля давления в камере приведен на рисунке В.4.
Рисунок В.4 - Пример цикла стерилизации с распылением воды
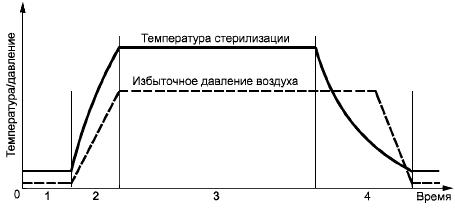
1 - подача воды; 2 - нагрев; 3 - выдерживание; 4 - охлаждение
Рисунок В.4 - Пример цикла стерилизации с распылением воды
В.3.4 Погружение в воду
Этот процесс сходен с процессом распыления воды, за исключением того, что продукт полностью погружается в воду. Этот процесс применяется для поддержания формы продукта.
Пример температурного профиля и профиля давления в камере приведен на рисунке В.5.
Рисунок В.5 - Пример цикла стерилизации погружением в воду
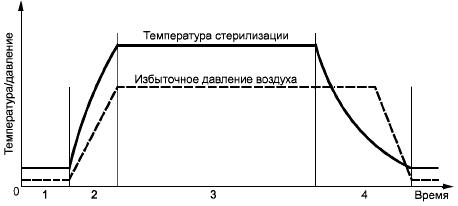
1 - подача воды; 2 - нагрев; 3 - выдерживание; 4 - охлаждение
Рисунок В.5 - Пример цикла стерилизации погружением в воду
ПРИЛОЖЕНИЕ С (справочное). Библиография
ПРИЛОЖЕНИЕ С
(справочное)
Примечание - См. также раздел 2.
[1] МЭК/НК 65А Системные аспекты (System aspects) - предварительное название Функциональная безопасность. Системы безопасности. Часть 3. Требования к программному обеспечению
[2] ИСО 9003-94 Системы качества. Модель для обеспечения качества при окончательном контроле и испытаниях
[3] ИСО 11737-2: Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытание на стерильность, проводимое при валидации процесса стерилизации
[4] Технический меморандум по здравоохранению. Политика управления - стерилизация. Лидс, Соединенное королевство: 1994. - Health Technical Memorandum 2010, Manegement policy-sterilization. NHS Estates. Leeds, UK: 1994
[5] Национальная ассоциация производителей консервов. Лабораторное пособие для изготовителей пищевых консервов: AVI Publishing. Вестпорт, СТ 1968. National Canners Association. Laboratory Manual for Food Canners and Processors: AVI Publishing. Westport, CT 1968
[6] Ассоциация по парентеральным лекарственным средствам. Валидация циклов стерилизации паром. Техническая монография PDA N 1, Филадельфия, РА, 1978. - Parenteral Drug Association (PDA), Validation of steam sterilization cycles, PDA Technical Monograph No.1. PDA Philadelphia, PA, 1978
[7] Пфлаг И.Дж. Микробиология и оборудование для процессов стерилизации. Университет Миннесоты, Отделение наук о продуктах питания, питании и Школа здоровья общества. Сент Пол, MN, 1979 - Pflug, I.J. Microbiology and engineering of sterilization processes. University of Minnesota, Department of Food Science and Nutrition and School of Public Health, St. Paul, MN, 1979
[8] Пфлаг И.Дж. и Холкомб Р.Г. Принципы тепловой деструкции микроорганизмов. Блок С.С, ред., Дезинфекция, стерилизация и консервирование. Леа и Фебингер, Филадельфия, 1983 - Pflug, I.J. and Holcomb, R.G. Principles of thermal destruction of microorganisms. In Block, S.S., ed. Disinfection, sterilization and preservation. Lea & Febiger, Philadelphia, PA, 1983