ГОСТ Р 50267.31-99
(МЭК 60601-2-31-94)
Группа Р07
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ЭЛЕКТРИЧЕСКИЕ
Часть 2
Частные требования безопасности к наружным кардиостимуляторам с внутренним источником питания
Medical electrical equipment. Part 2. Particular requirement for the safety of external cardiac pacemakers with internal power source
ОКС 11.040.60
ОКСТУ 9444
Дата введения 2001-01-01
Предисловие
1 РАЗРАБОТАН Закрытым акционерным обществом "ВНИИМП-ВИТА"
ВНЕСЕН Техническим комитетом по стандартизации ТК 11 "Медицинские приборы и аппараты"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 815-ст
3 Стандарт представляет собой полный аутентичный текст международного стандарта МЭК 60601-2-31-94 "Изделия медицинские электрические. Часть 2. Частные требования безопасности к наружным кардиостимуляторам с внутренним источником питания"
________________ Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт http://shop.cntd.ru. - Примечание изготовителя базы данных.
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Введение
Настоящий частный стандарт изменяет и дополняет ГОСТ 30324.0/ГОСТ Р 50267.0 "Изделия медицинские электрические. Часть 1. Общие требования безопасности" (далее - общий стандарт). Требования настоящего частного стандарта имеют приоритет по отношению к требованиям общего стандарта.
В настоящем частном стандарте методы испытаний выделены курсивом, термины набраны прописными буквами.
________________ В бумажном оригинале обозначения и номера стандартов и нормативных документов в пунктах *36 "Электромагнитная совместимость" и 50 "Точность рабочих характеристик" выделены курсивом, остальные по тексту документа приводятся обычным шрифтом. - Примечание изготовителя базы данных.
Перечень опасностей для ПАЦИЕНТА, создаваемых НАРУЖНЫМ КАРДИОСТИМУЛЯТОРОМ, и обоснование требований безопасности, содержащихся в настоящем стандарте, приведены в приложении АА. Номера пунктов и подпунктов, к которым даны обоснования, обозначены знаком (*). Приложение АА не является частью требований настоящего частного стандарта, но знание причин, обусловивших включение в стандарт этих требований, облегчает его применение.
РАЗДЕЛ ПЕРВЫЙ. ОБЩИЕ ПОЛОЖЕНИЯ
1 Область распространения и цель
Применяют пункт общего стандарта, за исключением:
*1.1 Область распространения
Дополнение
Настоящий стандарт устанавливает требования безопасности к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ (далее - ИЗДЕЛИЯМ), определение которых приведено в 2.1.101, питаемым от ВНУТРЕННЕГО ИСТОЧНИКА ЭЛЕКТРИЧЕСКОГО ПИТАНИЯ, а также КАБЕЛЯМ ПАЦИЕНТА, определение которых приведено в 2.1.104.
Настоящий частный стандарт не распространяется на ИЗДЕЛИЯ, которые могут каким-либо образом соединяться с СЕТЕВЫМ ИСТОЧНИКОМ ПИТАНИЯ; на ПРОВОДА-ЭЛЕКТРОДЫ для временной стимуляции или другие изделия для кардиологической стимуляции, которые либо:
1) являются составной частью изделия, выполняющего другие функции;
2) вводят стимул через грудную клетку внешним способом или в пищевод;
3) обеспечивают антитахикардическую терапию сверхчастой электростимуляцией;
4) обеспечивают анализ систем стимулирования.
Каждый из двух каналов ДВУХКАМЕРНОГО НАРУЖНОГО КАРДИОСТИМУЛЯТОРА должен отвечать требованиям настоящего стандарта.
Требования настоящего стандарта являются обязательными.
1.2 Цель
Замена
Целью настоящего частного стандарта является установление требований безопасности к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ в соответствии с определением по 2.1.101.
1.3 Частные стандарты
Дополнение
Настоящий частный стандарт изменяет и дополняет ГОСТ 30324.0/ГОСТ Р 50267.0 (далее - общий стандарт).
Нумерация разделов, пунктов и подпунктов настоящего частного стандарта соответствует нумерации разделов, пунктов и подпунктов общего стандарта. Изменения общего стандарта вводятся в частный стандарт с помощью следующих слов:
"замена" - означает, что пункт или подпункт общего стандарта полностью заменяется;
"дополнение" - означает, что текст частного стандарта является дополнительным к тексту общего стандарта;
"изменение" - означает, что пункты и подпункты общего стандарта используются в измененном виде для текста частного стандарта.
Пункты или рисунки, которые являются дополнительными к пунктам или рисункам общего стандарта, имеют нумерацию, начиная с цифры 101, дополнительные приложения обозначаются буквами АА, ВВ и дополнительные перечисления - буквами аа) bb) и т.д.
Когда используется термин "настоящий стандарт", это означает, что подразумеваются и частный и общий стандарты вместе.
Если в настоящем частном стандарте нет какого-либо раздела или пункта общего стандарта, значит он используется без изменений. Если какой-либо раздел общего стандарта не соответствует специфике частного стандарта, то в частном стандарте говорится о неприменимости соответствующего раздела.
2 Термины и определения
Применяют пункт общего стандарта, за исключением:
Дополнение
В настоящем частном стандарте применяют, кроме того, термины с соответствующими определениями по пункту 2 ГОСТ Р 50267.0.2, пункту 3 ИСО 5841-1 и приложению 1 ГОСТ 29191, а также приведенные ниже:
2.1.101 НАРУЖНЫЙ КАРДИОСТИМУЛЯТОР
КАРДИОСТИМУЛЯТОР с НЕИМПЛАНТИРУЕМЫМ ИМПУЛЬСНЫМ ГЕНЕРАТОРОМ и КАБЕЛЯМИ ПАЦИЕНТОВ (если они используются).
2.1.102 МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ
Максимальная частота желудочковой стимуляции, которая осуществляется импульсным генератором в ответ на спонтанную активность предсердия (в соотношении 1:1)
2.1.103 НЕИМПЛАНТИРУЕМЫЙ ИМПУЛЬСНЫЙ ГЕНЕРАТОР
ИЗДЕЛИЕ МЕДИЦИНСКОЕ ЭЛЕКТРИЧЕСКОЕ, предназначенное для использования вне тела человека, которое генерирует электрические импульсы, имеющие целью стимулировать сердце через ПРОВОД-ЭЛЕКТРОД или комбинацию ПРОВОДА-ЭЛЕКТРОДА и КАБЕЛЯ ПАЦИЕНТА.
2.1.104 КАБЕЛЬ ПАЦИЕНТА
Устройство, присоединяемое к зажимам НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА таким образом, чтобы расстояние между ним и стимулирующим ПРОВОДОМ-ЭЛЕКТРОДОМ могло быть увеличено.
2.1.105 РЕФРАКТЕРНЫЙ ПЕРИОД ПРЕДСЕРДИЙ ПОСЛЕ ЖЕЛУДОЧКОВОЙ ДЕПОЛЯРИЗАЦИИ (РППЖД)
Период после деполяризации желудочков (либо естественной, либо вызванной стимуляцией), во время которого любое событие в предсердиях не детектируется.
2.1.106 ОДНА КАМЕРА
Относится либо к предсердию, либо к желудочку.
5 Классификация
Применяют пункт общего стандарта, за исключением:
*5.2 В зависимости от степени защиты от поражения электрическим током:
Изменение
Исключить РАБОЧИЕ ЧАСТИ ТИПОВ В и BF.
6 Идентификация, маркировка и документация
Применяют пункт общего стандарта, за исключением:
6.1 Маркировка на наружной стороне ИЗДЕЛИЙ или их частей
Дополнение
*аа) Если ИЗДЕЛИЕ предназначено для работы с ОДНОЙ КАМЕРОЙ, то зажимы соединителя должны иметь ясноразличимую маркировку полюсов - положительного (+) и отрицательного (-).
*bb) Есди ИЗДЕЛИЕ предназначено для работы с ДВУМЯ КАМЕРАМИ, то зажимы должны быть маркированы, как это показано в таблице 101. При этом, если используется цвет для различения каналов, то канал желудочка должен маркироваться белым цветом, а канал предсердия любым контрастным цветом.
Таблица 101 - Маркировка зажима соединителя для ДВУХ КАМЕР сердца
Наименование канала | Символ | Маркировка на зажиме | |
Зажим положительный | Зажим отрицательный | ||
Канал предсердия | А+ | А- | ПРЕДСЕРДИЕ |
Канал желудочка | V+ | V- | ЖЕЛУДОЧЕК |
*сс) Средства для доступа к батарейному блоку должны быть легкоразличимы. Маркировка батарейного блока должна быть четкой и соответствовать маркировке по ГОСТ 28125 и ГОСТ Р МЭК 86-1 на батареи (если применимо), на нем также должно быть нанесено значение напряжения и обозначение типа. Четкая и постоянная маркировка на батарейном блоке должна также показывать правильную ориентацию батареи или батарей.
6.3 Маркировка органов управления и измерительных приборов
Дополнение
*аа) Если используется стабилизация тока стимулирующего импульса, то орган регулирования для установления выходного тока стимуляции или соответствующие средства индикации должны быть маркированы в единицах тока - миллиамперах (мА), проходящего через резистивную нагрузку 500 Ом ±1%. Если используется стабилизация напряжения стимулирующего импульса, то орган регулирования для установления выходного напряжения стимуляции или соответствующие средства индикации должны быть маркированы в единицах напряжения - вольтах (В) на резистивной нагрузке 500 Ом ±1%.
*bb) Орган управления по выбору ЧАСТОТЫ ИМПУЛЬСОВ или соответствующие средства индикации должны быть маркированы в импульсах в минуту.
*сс) Если имеется возможность выбора режима стимуляции, то на ИЗДЕЛИИ должно быть указано, какие есть возможные режимы стимуляции, при этом используются коды в соответствии с ГОСТ Р 51073.
6.8 ЭКСПЛУАТАЦИОННЫЕ ДОКУМЕНТЫ
6.8.2 Инструкция по эксплуатации
Перечисления *е), f), g), h). Замена:
"ИЗДЕЛИЯ, имеющие встроенную батарею
Инструкция по эксплуатации должна дополнительно включать:
- информацию по испытаниям, периодической замене батарей и подробное описание процедуры такой замены;
- информацию по зарядке и определению условий, когда указанный аккумулятор достигает такого состояния, что дальнейшая его перезарядка и использование могут привести к возникновению ОПАСНОСТИ;
- для ИЗДЕЛИЙ, использующих батареи, рекомендации по их удалению, если ИЗДЕЛИЕ предполагается хранить в течение длительного времени без использования;
- расчетный срок службы от новой батареи или полностью заряженного аккумулятора при окружающей температуре 20 °С и эксплуатации в установленных условиях;
- расчетный срок службы после включения ИНДИКАТОРА РАЗРЯДА БАТАРЕИ при эксплуатации в установленных условиях".
Дополнение
аа) Дополнительные инструкции по эксплуатации:
Инструкции по эксплуатации должны дополнительно включать следующие данные:
*1) Общее описание, пояснение к выполняемой функции и описание каждого взаимодействия сердца и ИМПУЛЬСНОГО ГЕНЕРАТОРА для каждого возможного режима стимуляции (см. ГОСТ Р 51073 в части описания режимов стимуляции).
*2) Конфигурацию разъемов, геометрию и/или размеры приборного разъема и инструкции по соединению ПРОВОДА(ОВ)-ЭЛЕКТРОДА(ОВ) или КАБЕЛЯ(ЕЙ) ПАЦИЕНТА с НЕИМПЛАНТИРУЕМЫМ ИМПУЛЬСНЫМ ГЕНЕРАТОРОМ.
*3) Электрические характеристики (включая при необходимости допуски) при температуре (20±2) °С и нагрузке 500 Ом ±1%, приведенные ниже, если нет других указаний:
- диапазоны БАЗОВОЙ ЧАСТОТЫ, ИНТЕРВАЛА ЗАДЕРЖКИ, МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ и ЧАСТОТЫ ИМПУЛЬСОВ ПРИ ПОМЕХАХ (при необходимости);
- АМПЛИТУДУ(Ы) ИМПУЛЬСА;
- ДЛИТЕЛЬНОСТЬ(И) ИМПУЛЬСА;
- диапазон ПОРОГА СРАБАТЫВАНИЯ (ЧУВСТВИТЕЛЬНОСТИ) как для положительной, так и отрицательной полярностей (если обеспечивается функция чувствительности);
- ПЕРИОДЫ ПАУЗЫ усилителя (если обеспечивается функция чувствительности);
- РЕФРАКТЕРНЫЙ(ЫЕ) ПЕРИОД(Ы) (стимуляции и детектирования) и интервал(ы) А-V (если необходимо);
- режим работы в присутствии помех;
- предельную частоту (защита от выхода частоты стимуляции из-под контроля) импульсов в минуту.
*4) Электрические характеристики во время работы ИНДИКАТОРА РАЗРЯДА БАТАРЕИ (включая при необходимости допуски) при температуре (20±2) °С и нагрузке 500 Ом ±1%, приведенные ниже:
- БАЗОВУЮ ЧАСТОТУ или эквивалентный БАЗОВЫЙ ПЕРИОД СЛЕДОВАНИЯ ИМПУЛЬСОВ;
- АМПЛИТУДУ(Ы) ИМПУЛЬСА;
- ДЛИТЕЛЬНОСТЬ(И) ИМПУЛЬСА;
- ПОРОГ СРАБАТЫВАНИЯ (ЧУВСТВИТЕЛЬНОСТЬ) (если обеспечивается функция чувствительности);
- изменение режимов (если это применимо).
*5) Предупреждение об опасности непреднамеренного ввода ТОКА УТЕЧКИ в сердце, если ИЗДЕЛИЕ, работающее от СЕТЕВОГО ИСТОЧНИКА ПИТАНИЯ, соединено с системой ПРОВОДОВ-ЭЛЕКТРОДОВ.
*6) Предупреждения в отношении воздействия терапевтических и диагностических энергетических источников (например, наружная кардиоверсия, диатермия, высокочастотное хирургическое оборудование, магнитно-резонансная визуализация и другие аналогичные источники).
*7) Предупреждение о том, что КАБЕЛЬ ПАЦИЕНТА должен быть подсоединен к НЕИМПЛАНТИРУЕМОМУ ИМПУЛЬСНОМУ ГЕНЕРАТОРУ до того, как будут подсоединены стимулирующие ПРОВОДА-ЭЛЕКТРОДЫ к КАБЕЛЮ ПАЦИЕНТА.
*8) Предупреждение о том, чтобы при ручном управлении ПРОВОДАМИ-ЭЛЕКТРОДАМИ, находящимися внутри ПАЦИЕТА, штырьки зажимов или открытые металлические части не контактировали с электропроводящими или влажными поверхностями.
*9) Для ИЗДЕЛИЙ, в которых используются первичные батареи, - информацию, касающуюся с обозначения батарей, которая должна быть получена от предприятия-изготовителя.
*10) Если используется первичная батарея, - предупреждение о возможной опасности применения батарей, отличных от тех, которые рекомендованы изготовителем (например, короткий срок службы батареи после индикации снижения уровня работы батареи, ухудшение работы ИЗДЕЛИЯ, общее снижение срока службы батареи, ошибочная стимуляция или ее отсутствие).
*11) Ограничения к условиям окружающей среды относительно хранения ИЗДЕЛИЯ непосредственно перед его применением.
*12) Рекомендацию, обращающую внимание пользователя на необходимость периодического технического обслуживания ИЗДЕЛИЯ так же, как и на необходимость технического обслуживания ИЗДЕЛИЯ после какого-либо сбоя или несчастного случая, независимо от его использования, особенно на:
- очистку и дезинфекцию КАБЕЛЕЙ;
- очистку и дезинфекцию НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА;
- осмотр кабелей и соединений для выявления возможных дефектов, например, ослабление соединений, износ и обрыв соединений в результате движения ПАЦИЕНТА;
- функциональные проверки, включая срабатывание клавиш, переключателей и т.д., особенно, если ИЗДЕЛИЕ перенесло сильный удар, например, при падении;
- зарядку батареи, если необходимо, и
- калибровку, если необходимо.
*7 Потребляемая мощность
Не применяют.
РАЗДЕЛ ВТОРОЙ. УСЛОВИЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Применяют раздел общего стандарта.
РАЗДЕЛ ТРЕТИЙ. ЗАЩИТА ОТ ОПАСНОСТЕЙ ПОРАЖЕНИЯ ЭЛЕКТРИЧЕСКИМ ТОКОМ
Применяют пункты общего стандарта, за исключением:
14 Требования, относящиеся к классификации
Применяют пункт общего стандарта, за исключением:
*14.1 ИЗДЕЛИЯ КЛАССА I
Не применяют.
*14.2 ИЗДЕЛИЯ КЛАССА II
Не применяют.
*14.4 ИЗДЕЛИЯ КЛАССА I и КЛАССА II
Не применяют.
*14.5 ИЗДЕЛИЯ С ВНУТРЕННИМ ИСТОЧНИКОМ ПИТАНИЯ
Замена
ИЗДЕЛИЕ считается таковым, если не предусмотрены внешние соединения с ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ или если электрическое соединение с ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ (например, с перезаряжаемой батареей) используется только после физического и электрического отделения ВНУТРЕННЕГО ИСТОЧНИКА ЭЛЕКТРОПИТАНИЯ от остальной части ИЗДЕЛИЯ.
19 ДЛИТЕЛЬНЫЕ ТОКИ УТЕЧКИ и ДОПОЛНИТЕЛЬНЫЕ ТОКИ В ЦЕПИ ПАЦИЕНТА
Применяют пункт общего стандарта, за исключением:
19.1 Общие требования
*19.1 b)
Дополнение
Во время испытания на ТОКИ УТЕЧКИ выход НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА следует отключать, если это возможно. Если этого не делать, то ток стимуляции не следует рассматривать как часть ТОКА УТЕЧКИ.
19.3 Допустимые значения
*19.3 а)
Дополнение
Допустимый ДОПОЛНИТЕЛЬНЫЙ ТОК В ЦЕПИ ПАЦИЕНТА в НОРМАЛЬНЫХ УСЛОВИЯХ составляет 0,001 мА. Допустимый ДОПОЛНИТЕЛЬНЫЙ ТОК В ЦЕПИ ПАЦИЕТА в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ составляет 0,005 мА.
19.4 Испытания
*j) Измерение ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА
Перечисление 4. Замена
4) Для измерения ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА ИЗДЕЛИЕ должно быть соединено, как показано на рисунке 27 общего стандарта, с измерительным устройством, работающим на постоянном токе и имеющим входное сопротивление 100 кОм. ИЗДЕЛИЕ должно быть соединено с измерительным устройством в течение не менее 5 мин, прежде чем будут выполнены измерения ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА. Если он измерен четко перед стимулирующим импульсом, то измеренное напряжение не должно превышать 100 мВ в НОРМАЛЬНЫХ УСЛОВИЯХ и 500 мВ - в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ.
РАЗДЕЛ ЧЕТВЕРТЫЙ. ЗАЩИТА ОТ МЕХАНИЧЕСКИХ ОПАСНОСТЕЙ
Применяют раздел общего стандарта.
РАЗДЕЛ ПЯТЫЙ. ЗАЩИТА ОТ ОПАСНОСТЕЙ НЕЖЕЛАТЕЛЬНОГО ИЛИ ЧРЕЗМЕРНОГО ИЗЛУЧЕНИЯ
Применяют пункты общего стандарта, за исключением:
*36 Электромагнитная совместимость
Замена
Конструкция ИЗДЕЛИЯ должна гарантировать достаточную степень защиты от ОПАСНОСТЕЙ, вызываемых повторяемыми ЭЛЕКТРОСТАТИЧЕСКИМИ РАЗРЯДАМИ.
Соответствие требованию проверяют следующим испытанием.
ИЗДЕЛИЕ устанавливают, как указано в ГОСТ 29191. После проведения процедур по ГОСТ 29191 при использовании МЕТОДА ВОЗДУШНОГО РАЗРЯДА к точкам и поверхностям ИЗДЕЛИЯ, которые легкодоступны в НОРМАЛЬНЫХ УСЛОВИЯХ и доступны во время технического обслуживания ПОЛЬЗОВАТЕЛЕМ, прикладывают испытательные напряжения, указанные в таблице 102.
Испытание проводят единичными разрядами. Испытательное напряжение подают ступенчато, начиная с уровня жесткости 1. Определенное число единичных разрядов, выбранное в соответствии с таблицей 102, прикладывают к каждой испытательной точке. Между разрядами допускается делать достаточный интервал во времени, чтобы можно было определить, случилось ли какое-нибудь нарушение в ИЗДЕЛИИ. Последний, указанный в таблице, уровень жесткости не должен превышаться, если изготовителем не указан более высокий уровень УСТОЙЧИВОСТИ к ЭЛЕКТРОСТАТИЧЕСКОМУ РАЗРЯДУ.
Ни при каком уровне жесткости не должно наблюдаться снижение функциональных характеристик ИЗДЕЛИЯ, которые не восстанавливаются, а также никакого повреждения ИЗДЕЛИЯ (его частей) или программного обеспечения, или потери данных. Непредусмотренной передачи энергии ПАЦИЕНТУ во время этих испытаний не должно происходить ни при одном уровне жесткости.
На уровнях жесткости 1 или 2 ИЗДЕЛИЕ должно сохранять свои функциональные характеристики в пределах, указанных в спецификациях.
На уровнях жесткости 3 и 4 допустимо временное ухудшение или потеря функциональных или эксплуатационных характеристик, которые требуют вмешательства ОПЕРАТОРА.
Общие критерии оценки воздействия статических разрядов на ИЗДЕЛИЕ - по ГОСТ 29191.
Таблица 102- Требования к статическому разряду
Уровень жесткости | Испытательное напряжение, кВ | Число одиночных разрядов |
1 | 2 | 10 |
| ||
РАЗДЕЛ ШЕСТОЙ. ЗАЩИТА ОТ ОПАСНОСТЕЙ ВОСПЛАМЕНЕНИЯ ГОРЮЧИХ СМЕСЕЙ АНЕСТЕТИКОВ
Применяют раздел общего стандарта.
РАЗДЕЛ СЕДЬМОЙ. ЗАЩИТА ОТ ЧРЕЗМЕРНЫХ ТЕМПЕРАТУР И ДРУГИХ ОПАСНОСТЕЙ
Применяют пункты 42 и 43 общего стандарта.
44 Перелив, расплескивание, утечка, влажность, проникание жидкостей, очистка, стерилизация и дезинфекция
Применяют пункт общего стандарта, за исключением:
*44.2 Перелив
Не применяют.
*44.3 Расплескивание
Не применяют.
*44.4 Утечка
Не применяют.
*44.6 Проникание жидкостей
Замена
ИЗДЕЛИЕ должно быть сконструировано так, чтобы в случае расплескивания жидкости (случайное увлажнение) опасность не возникала.
Соответствие требованию проверяют следующим испытанием.
ИЗДЕЛИЕ помещают в наиболее неблагоприятные условия НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ с прикрепленным КАБЕЛЕМ ПАЦИЕНТА. На ИЗДЕЛИЕ расплескивают 400 мл раствора поваренной соли концентрации 9 г/л с высоты 30 см. Все 400 мл должны быть вылиты на ИЗДЕЛИЕ менее чем за 5 с. После расплескивания ИЗДЕЛИЕ не должно оставаться погруженным в раствор поваренной соли более чем на 5 мм.
Сразу по истечении 30 с пребывания под воздействием раствора поваренной соли ИЗДЕЛИЕ удаляют из указанного раствора и на КОРПУСЕ ИЗДЕЛИЯ вытирают видимые следы влажности.
ИЗДЕЛИЕ должно работать в соответствии с техническими условиями на него во время и после расплескивания.
По истечении не менее 24 ч после этого испытания ИЗДЕЛИЕ должно работать в соответствии с техническими условиями на него. После этой проверки ИЗДЕЛИЕ разбирают и осмотр должен показать, что жидкость не проникла в электронные части.
49 Прерывание электропитания
Применяют пункт общего стандарта, за исключением:
Дополнение
*49.101 В ИЗДЕЛИИ должен быть предусмотрен ИНДИКАТОР РАЗРЯДА БАТАРЕИ, который показывает, когда должен быть заменен источник питания.
Соответствие требованию проверяют осмотром и функциональным испытанием.
РАЗДЕЛ ВОСЬМОЙ. ТОЧНОСТЬ РАБОЧИХ ХАРАКТЕРИСТИК И ЗАЩИТА ОТ ПРЕДСТАВЛЯЮЩИХ ОПАСНОСТЬ ВЫХОДНЫХ ХАРАКТЕРИСТИК
Применяют раздел общего стандарта, за исключением:
50 Точность рабочих характеристик
Применяют пункт общего стандарта, за исключением:
50.2 Точность органов управления и измерительных приборов
Дополнение
*аа) Измеренные значения параметров, приведенных в таблице 103, должны быть в пределах допусков, указанных изготовителем, при установке органа регулирования ЧАСТОТЫ ИМПУЛЬСОВ на 60 и 120 импульсов в минуту при полностью заряженной батарее и НЕИМПЛАНТИРУЕМОМ ИМПУЛЬСНОМ ГЕНЕРАТОРЕ при (20±2) °С. Если диапазон регулирования ЧАСТОТЫ ИМПУЛЬСОВ отличается от значений 60 и (или) 120 импульсов в минуту, то испытание следует проводить при максимально и минимально допустимых значениях.
Соответствие требованию проверяют либо соответствующими методами, которые приведены ниже, либо другими методами, при условии, что они дают точность такую же или выше, чем та, которая указана в таблице 103. В спорных случаях применяют испытание, приведенное ниже, или испытание по ГОСТ Р 51073.
Таблица 103 - Погрешность измерения
Наименование параметра | Погрешность измерения, % |
АМПЛИТУДА ИМПУЛЬСОВ | ±5 |
ДЛИТЕЛЬНОСТЬ ИМПУЛЬСОВ | ±5 |
ЧАСТОТА ИМПУЛЬСОВ | ±0,5 |
ПОРОГ СРАБАТЫВАНИЯ (ЧУВСТВИТЕЛЬНОСТЬ)(если применимо) | ±10 |
ИНТЕРВАЛ ЗАДЕРЖКИ | ±10 |
РЕФРАКТЕРНЫЙ ПЕРИОД (если применимо) | ±10 |
A-V-ИНТЕРВАЛ (если применимо) | ±5 |
МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ (если применимо) | ±0,5 |
Измерение МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ проводят следующим образом:
При полностью заряженной батарее и НЕИМПЛАНТИРУЕМОМ ИМПУЛЬСНОМ ГЕНЕРАТОРЕ в ПОСЛЕДОВАТЕЛЬНОМ A-V РЕЖИМЕ С ДЕТЕКТИРОВАНИЕМ АКТИВНОСТИ И СТИМУЛЯЦИЕЙ В ОБЕИХ КАМЕРАХ сердца (DDD) при температуре (20±2) °С ИЗДЕЛИЕ подсоединяют в соответствии со схемой, приведенной на рисунке 101. Описание испытательной аппаратуры - по ГОСТ Р 51073. Настройку сигнального генератора осуществляют до тех пор, пока испытательный сигнал не станет равным примерно 2е или 2е
(где 2е
и 2е
- положительная и отрицательная полярности испытательного сигнала), как определено в В.3.2 ИСО 5841-1.
Рисунок 101 - Измерительная схема для МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ
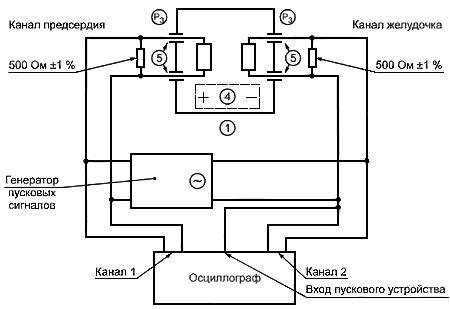
Объяснения к символам - по рисункам 10-27 общего стандарта.
Рисунок 101 - Измерительная схема для МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ [см. 50.2 аа)]
Задержку от момента запуска сигнального генератора до появления на его выходе испытательного сигнала обозначают буквой . Настраивают генератор сигналов так, чтобы задержка
была немного больше РППЖД. Медленно увеличивают D до тех пор, пока стимулирующий импульс желудочка не начнет отслеживать дополнительную задержку, что отражается на 2-м канале осциллографа. Измеряют интервал между последовательными стимулирующими импульсами в канале 2 в миллисекундах. Обозначают это как интервал
в мс.
Настраивают осциллограф таким образом, чтобы получить изображение, как это показано на рисунке 102.
Рисунок 102 - Первоначальное изображение на экране осциллографа при измерении МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ
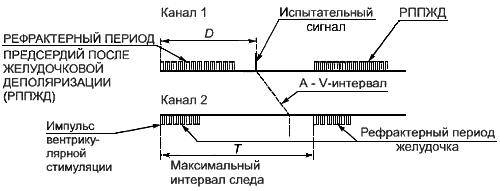
D>РППЖД
МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ равна 60000/имп./мин
(где в мс)
Рисунок 102 - Первоначальное изображение на экране осциллографа при измерении МАКСИМАЛЬНОЙ ЧАСТОТЫ СЛЕЖЕНИЯ [см. 50.2 аа)]
МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ равна 60000/ имп./мин.
*bb) АМПЛИТУДА ИМПУЛЬСОВ (напряжение или ток) в НЕИМПЛАНТИРУЕМОМ ИМПУЛЬСНОМ ГЕНЕРАТОРЕ при температуре (20±2) °С не должна отличаться от указанного значения более чем на значение (в процентах), указанное изготовителем в спецификациях, при изменении нагрузки от 200 до 1000 Ом при частоте импульсов 70 имп./мин и полностью заряженной батарее.
Соответствие требованию проверяют с помощью использования основного метода испытания, указанного в ГОСТ Р 51073, и при нагрузках испытаний 200 Ом ±1% и 1000 Ом ±1%, для того чтобы определить зависимость АМПЛИТУДЫ ИМПУЛЬСОВ от сопротивления нагрузки.
51 Защита от представляющих опасность выходных характеристик
Применяют пункт общего стандарта, за исключением:
Дополнение
51.101 Защита от опасностей электрического происхождения
*а) Защита от воздействия дефибрилляционного оборудования
Оборудование должно соответствовать требованиям ГОСТ Р 51073.
*b) Защита от воздействия высокочастотного хирургического оборудования
В стадии рассмотрения.
*с) Защита от воздействия коротковолнового терапевтического оборудования
В стадии рассмотрения.
*51.102 Защита от случайного изменения положения органов управления и неумелого обращения
Должны быть предусмотрены средства, чтобы изменение установки органов управления требовало преднамеренных действий.
Соответствие требованию проверяют осмотром.
*51.103 Защита от снижения напряжения на батарее
При срабатывании ИНДИКАТОРА РАЗРЯДА БАТАРЕИ измеренные значения параметров ИЗДЕЛИЯ, перечисленные в 6.8.2 аа), перечисление 4, дополнительных ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТОВ, должны быть в пределах допусков, установленных изготовителем при измерениях с НЕИМПЛАНТИРУЕМЫМ ИМУЛЬСНЫМ ГЕНЕРАТОРОМ с нагрузкой 500 Ом ±1% при температуре (20±2) °С.
Соответствие требованию проверяют любым методом при условии, что этот метод дает точность не хуже указанной в таблице 103.
51.104 Предельная частота (защита от неконтролируемого повышения частоты стимуляции сердца)
*а) Должны быть предусмотрены средства для ограничения ЧАСТОТЫ ИМУЛЬСОВ в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ до значения, установленного изготовителем.
Соответствие требованию, установленному изготовителем НЕИМПЛАНТИРУЕМЫХ ИМПУЛЬСНЫХ ГЕНЕРАТОРОВ, проверяют осмотром.
*b) Если ИЗДЕЛИЕ позволяет обеспечить повышение ЧАСТОТЫ стимулирующих ИМПУЛЬСОВ выше заданного предела, то защита от воможности превышения предельного значения стимулирующей частоты может быть заблокирована для этого режима.
Соответствие требованию проверяют осмотром и испытанием на функционирование.
*51.105 Реверсия, вызванная электромагнитными помехами
В присутствии ощутимых электрических помех НЕИМПЛАНТИРУЕМЫЙ ИМПУЛЬСНЫЙ ГЕНЕРАТОР должен вернуться к режиму стимуляции и ЧАСТОТЕ ИМПУЛЬСОВ, указанным изготовителем, до тех пор, пока помехи не прекратятся.
Изготовитель должен предусмотреть нормативный документ для проверки соответствия этому требованию.
*51.106 МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ
В ПОСЛЕДОВАТЕЛЬНЫХ A-V-РЕЖИМАХ С ДЕТЕКТИРОВАНИЕМ АКТИВНОСТИ И СТИМУЛЯЦИЕЙ В ОБЕИХ КАМЕРАХ сердца (если это применимо) должны быть предусмотрены средства для установления предела частоты, до которой желудочки стимулируются, реагируя на спонтанную активность предсердия. ИЗДЕЛИЕ должно реагировать на повышенные предсердные ритмы таким образом, как это установлено изготовителем.
Соответствие требованию проверяют осмотром и функциональным испытанием.
РАЗДЕЛ ДЕВЯТЫЙ. НЕНОРМАЛЬНАЯ РАБОТА И УСЛОВИЯ НАРУШЕНИЯ; ИСПЫТАНИЯ НА ВОЗДЕЙСТВИЕ ВНЕШНИХ ФАКТОРОВ
Применяют раздел общего стандарта.
РАЗДЕЛ ДЕСЯТЫЙ. ТРЕБОВАНИЯ К КОНСТРУКЦИИ
Применяют пункты общего стандарта, за исключением:
56 Компоненты и общая компоновка
Применяют пункт общего стандарта, за исключением:
56.3 Соединения. Общие положения
Дополнение
*аа) Соединитель между КАБЕЛЕМ ПАЦИЕНТА и НЕИМПЛАНТИРУЕМЫМ ИМПУЛЬСНЫМ ГЕНЕРАТОРОМ должен быть защищен таким образом, чтобы предотвратить контакт с зажимами КАБЕЛЯ ПАЦИЕНТА в то время, когда он соединен с зажимами выхода НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА.
Соответствие требованию проверяют осмотром.
Дополнение
*56.101 Индикатор выхода
ИЗДЕЛИЕ должно иметь встроенные средства индикации, если оно предназначено для выдачи импульсов стимуляции.
Соответствие требованию проверяют осмотром и функциональным испытанием.
*56.102 Индикатор входа
Если в ИЗДЕЛИИ предусмотрены средства для определения чувствительности, то ИЗДЕЛИЕ должно иметь встроенные средства индикации сигналов, связанных с электрической активностью сердца. Эти средства должны реагировать на сигналы, указанные изготовителем для выбранного режима стимуляции и других рабочих характеристик.
Соответствие требованию проверяют осмотром и функциональным испытанием.
Применяют приложения А-К общего стандарта.
ПРИЛОЖЕНИЕ L (справочное). Нормативные ссылки
ПРИЛОЖЕНИЕ L
(справочное)
В настоящем частном стандарте использованы ссылки на следующие стандарты: | |
ГОСТ 28125-89 (МЭК 86-2-87) | Элементы и батареи первичные. Основные параметры и размеры |
ГОСТ 29191-91 (МЭК 801-2-91) | Совместимость технических средств электромагнитная. Устойчивость к электростатическим разрядам. Технические требования и методы испытаний |
ГОСТ 30324.0-95 (МЭК 601-1-88) | Изделия медицинские электрические. Часть 1. Общие требования безопасности |
ГОСТ Р 50267.0.2-95 (МЭК 601-1-2-93) | Изделия медицинские электрические. Часть 1. Общие требования безопасности. 2. Электромагнитная совместимость. Требования и методы испытаний |
________________ | |
ГОСТ Р 51073-97 | Электрокардиостимуляторы имплантируемые. Общие технические требования и методы испытаний |
ГОСТ Р МЭК 86-1-96 | Батареи первичные. Часть 1. Общие положения |
ИС0 5841-1-89 | Кардиостимуляторы. Часть 1. Имплантируемые кардиостимуляторы |
_______________
| |
ПРИЛОЖЕНИЕ АА (справочное). Общие положения и обоснования
ПРИЛОЖЕНИЕ АА
(справочное)
Настоящее приложение поясняет причины введения отдельных требований в настоящий частный стандарт в дополнение к ГОСТ 30324.0/ГОСТ Р 50267.0 и является полезным материалом при пересмотре, изучении и применении настоящего стандарта.
Обоснование предназначено для тех, кто хорошо знаком с предметом настоящего частного стандарта, но не принимал участия в его разработке. Там, где причины введения требований для таких специалистов очевидны, обоснование не приводится. Понимание причин введения основных требований считается важным для применения стандарта. Кроме того, по мере изменения клинической практики, технологического развития внесение изменений в стандарт будет осуществляться с пониманием проблем, которые возникали ранее при его разработке.
Анализ опасностей
НАРУЖНЫЕ КАРДИОСТИМУЛЯТОРЫ используют для стимуляции ПАЦИЕНТА с помощью временной высокоинтенсивной блокады сердца перед имплантацией имплантируемого кардиостимулятора, а также для временной стимуляции, связанной с другими медицинскими процедурами, например с операцией на открытом сердце, а также для диагностики. На безопасность ПАЦИЕНТА оказывают воздействие применяемые медицинские процедуры, понимание больничным персоналом роли оборудования и работа самого оборудования. Требования, устанавливаемые этим стандартом, считаются достаточными для обеспечения приемлемого уровня безопасности.
В качестве основы для обеспечения безопасности был разработан перечень опасностей, которые могут возникнуть для ПАЦИЕНТОВ в связи с применением НАРУЖНЫХ КАРДИОСТИМУЛЯТОРОВ. Результаты этого анализа сведены в таблицу АА.1. Чтобы облегчить ознакомление с документом, в таблицу включены ссылки на пункты стандарта, в которых описывается опасность или средство ее устранения.
Предварительный вывод, основанный на опыте клинической практики, показывает, что нарушение в процессе стимуляции является наиболее вероятным случаем опасности среди перечисленных.
Таблица АА.1 - Перечень возможных опасностей, источником которых может быть НАРУЖНЫЙ КАРДИОСТИМУЛЯТОР
Опасность | Причина | Средство устранения | Номер пункта настоящего стандарта |
Нарушение стимуляции | Снижение работоспособности батареи | Индикатор разряда батареи | 49.101 |
Плохое соединение | Испытание качества соединения | 6.8.2 аа) 12) | |
Повышение порога стимуляции | Проверка клинической методики | Не оговаривается настоящим стандартом | |
Повышение чувствительности | Проверка клинической методики | Не оговаривается настоящим стандартом | |
Стабильность параметров при пониженном напряжении батареи | 6.8.2 аа) 4) и 51.103 | ||
Дефект | Индикатор входа | 56.102 | |
Защита от воздействия дефибриллятора | 51.101 а) | ||
Защита от высокочастотной хирургической аппаратуры | 51.101 b) | ||
Защита от коротковолновой терапии | 51.101 с) | ||
Защита от расплескивания | 44.3 | ||
Статический электрический разряд | Пункт 36 | ||
Обслуживание | 6.8.2 аа) 12) | ||
Индикатор выхода | 56.101 | ||
Неправильная настройка | Защитные средства | 51.102 | |
Маркировка органов управления | 6.3 | ||
Смещение проводов-электродов | Проверка клинической методики | Не оговаривается настоящим стандартом | |
Высокая частота стимуляции | Дефект | Установление предельной частоты (защита от сбоя стимулирующей частоты) | 51.104 а) |
Неумелое обращение | Защитные средства | 51.102 | |
Временная высокая частота | Защитные средства | 51.104 b) | |
Тахиаритмия предсердия | МАКСИМАЛЬНАЯ ЧАСТОТА СЛЕЖЕНИЯ | 51.106 | |
Нежелательная стимуляция | Снижение чувствительности | Проверка клинической методики | Не оговаривается настоящим стандартом |
Стабильность параметров при снижении напряжения на батарее | 6.8.2 аа) 4) и 51.103 | ||
Индикатор входа | 56.102 | ||
Разряд батареи | Индикатор разряда батареи | 49.101 | |
Неправильная настройка | Защитные средства | 51.102 | |
Маркировка органов управления | 6.3 | ||
Помехи | Реверсия режима и параметров от помехи | 6.8.2 аа) 3) и 51.105 | |
Предупреждение | 6.8.2 аа) 6) | ||
Плохое соединение либо провода-электрода, либо батареи | Испытание соединений | 6.8.2 аа) 12) | |
Дефект | См. нарушения в стимуляции | - | |
Микрофоника | Реверсия режима и параметров от помехи | 6.8.2 аа) 3) и 51.105 | |
Микромакрошок | Ток утечки | Установление предельного тока утечки | Пункты 5, 14 и 19 |
Подвод тока | Предупреждения | 6.8.2 аа) 5), 6.8.2 аа) 6), 6.8.2 аа) 7) и 6.8.2. аа) 8) | |
Защитные средства | 56.3 аа) | ||
Повреждение тканей/электродов | Дополнительные токи в цепи пациента | Ограничение предельных дополнительных токов в цепи пациента | 19.3 |
Предварительный вывод, основанный на опыте клинической практики, показывает, что нарушение в процессе стимуляции является наиболее вероятным случаем опасности среди перечисленных.
Обоснования к отдельным подпунктам
П1.1 Область применения ограничена по следующим соображениям:
- источник питания ограничен ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ, поскольку ИЗДЕЛИЕ должно перемещаться вместе с ПАЦИЕНТОМ. ИЗДЕЛИЕ, подсоединенное к ЭЛЕКТРОСЕТИ, создало бы дополнительные, присущие ему, проблемы безопасности;
- настоящий стандарт не распространяется на устройства с ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ, которые могут выполнять функции стимуляции в то время, когда они присоединены к ЭЛЕКТРОСЕТИ для перезарядки ВНУТРЕННЕГО ИСТОЧНИКА ЭЛЕКТРОПИТАНИЯ. Включение таких устройств в область распространения стандарта потребовало бы, чтобы ИЗДЕЛИЕ имело двойную классификацию и обладало дополнительными характеристиками безопасности. Перезарядка должна быть невозможной на месте проведения процедуры даже в том случае, если устройство стимуляции прекращает работать во время процесса перезарядки. Это означает, что батарея должна быть не только электрически отсоединена от ИЗДЕЛИЯ, но и физически удалена от него до перезарядки;
- ИЗДЕЛИЯ, которые осуществляют стимуляцию наряду с другими функциями, требуют отдельного рассмотрения с надлежащим учетом всех остальных функций;
- ИЗДЕЛИЯ для трансторакальной и чрезпищеводной стимуляции дают более высокие энергии на выходе, которые не подходят для прямой кардиостимуляции;
- ИЗДЕЛИЯ антитахикардические создают ряд клинических проблем безопасности, которые требуют отдельного рассмотрения в соответствии с их назначением.
КАБЕЛИ ПАЦИЕНТА не входят в область распространения настоящего частного стандарта, так как они обычно используются в качестве удлинителей для подсоединения к генератору импульсов при стимуляции ПАЦИЕНТА во время хирургической операции и в послеоперационный период, а также во время длительных периодов стимуляции.
ПРОВОДА-ЭЛЕКТРОДЫ не входят в область распространения настоящего частного стандарта, поскольку они требуют отдельного рассмотрения, в зависимости от типа и подвода их к сердцу (венозного, эпикардиального).
П5.2 РАБОЧИЕ ЧАСТИ ТИПА В и РАБОЧИЕ ЧАСТИ ТИПА BF исключены, так как для ПРЯМОГО ПРИМЕНЕНИЯ НА СЕРДЦЕ применимы только РАБОЧИЕ ЧАСТИ ТИПА CF.
П6.1 аа) Так как НАРУЖНЫЕ КАРДИОСТИМУЛЯТОРЫ обычно требуются в критических ситуациях, необходимо наличие дополнительной информации о правильном подсоединении к ПРОВОДАМ-ЭЛЕКТРОДАМ, помимо имеющейся в ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТАХ. Неправильное подсоединение выходных зажимов (например, канала предсердия к желудочковому ПРОВОДУ-ЭЛЕКТРОДУ) может привести к неправильной и потенциально небезопасной работе стимулятора (стимуляция высокой частотой или ошибочное определение чувствительности). Для дифференциации каналов используется разная расцветка (синяя и белая) для того, чтобы был контраст, не позволяющий спутать их при нарушенном цветовом восприятии.
П6.1 bb) Доступ к батарейному блоку при удалении батареи для перезарядки или ее замене - это обычное требование при обслуживании ИЗДЕЛИЯ. Для того чтобы при предотвратить неправильное функционирование или потенциальную поломку ИЗДЕЛИЯ, необходима быстрая идентификация нужного типа батарей и правильная их ориентация.
П6.3 аа), bb) Точная установка уровней выходной энергии и ЧАСТОТЫ стимулирующего ИМПУЛЬСА считается очень важным фактором для безопасной работы ИЗДЕЛИЯ.
П6.3 cc) Для того чтобы понятно выразить основное назначение импульсного генератора, принят код из трех букв (см. ГОСТ Р 51073).
П6.8.2 е), f), g), h) Перезаряжаемые батареи не могут перезаряжаться бесконечно долго. В зависимости от химического заполнения и способа перезарядки батареи иногда не выдерживают указанный изготовителем срок службы. Поэтому изготовитель, который указывает, что нужно использовать перезаряжаемые батареи, должен обеспечить их инструкциями, которые дают возможность ПОЛЬЗОВАТЕЛЮ определить момент, когда батарея не сможет удовлетворять указанному сроку службы. Хорошо изготовленные батареи не должны течь при соблюдении рекомендуемых условий хранения и использования. Однако все батареи имеют тенденцию к утечке при некоторых условиях. Утечка батареи может привести к разрушению ИЗДЕЛИЯ. Опыт показывает, что лучше вынимать батарею, если заведомо известно, что ИЗДЕЛИЕ долго не будет использоваться.
Оценка срока службы осуществляется при полностью заряженных батареях. Батареи должны быть свежими и полностью заряженными.
Знание срока службы ИЗДЕЛИЯ, после того как работоспособность батареи снижается, важно для решения вопроса о срочности замены или перезарядки источника питания, что может быть достигнуто при срабатывании индикатора разряда батареи.
П6.8.2 аа) 1) Знание свойств и характеристик импульсного генератора необходимо при выборе НАРУЖНОГО КАРДИОСТИМУЛЯТОРА для использования на ПАЦИЕНТЕ. Чтобы можно было сделать выбор соответствующих свойств и характеристик, необходимо чтобы они были сравнимые, то есть чтобы они были основаны на общих методиках и допущениях.
П6.8.2 аа) 2) НЕИМПЛАНТИРУЕМЫЕ ИМПУЛЬСНЫЕ ГЕНЕРАТОРЫ и КАБЕЛИ ПАЦИЕНТА присоединяются к различным ПРОВОДАМ-ЭЛЕКТРОДАМ с различными конфигурациями штырьковых разъемов. Коннекторные части ПРОВОДА-ЭЛЕКТРОДА должны быть хорошо закреплены в разъеме НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА и КАБЕЛЯ ПАЦИЕНТА для обеспечения хорошего электрического и механического соединения.
П6.8.2 аа) 3) Электрические характеристики согласуются с общими положениями, принятыми в нормативных документах на ИМПЛАНТИРУЕМЫЕ ИМПУЛЬСНЫЕ ГЕНЕРАТОРЫ. Испытательная нагрузка 500 Ом - это значение, которое указано для ИМПЛАНТИРУЕМЫХ ИМПУЛЬСНЫХ ГЕНЕРАТОРОВ. Резистор с допускаемым отклонением сопротивления в пределах ±1% выбран в качестве испытательной нагрузки, поскольку такие резисторы доступны и не очень дороги. Кроме того, испытательная нагрузка с допускаемым отклонением в пределах ±1% наиболее соответствует заданным требованиям измерения АМПЛИТУДЫ ИМПУЛЬСА с точностью ±5% (см. таблицу 103). К допуску дано обоснование: для возможности общей оценки функционирования кардиостимулятора без специальных приборов принимается допуск в пределах ±5%.
Рабочая температура (20±2) °С типична для диапазонов, указанных в 10.2.1 общего стандарта. Рабочая температура (20±2) °С также является температурой, при которой испытания на разряд батареи должны выполняться в соответствии с ГОСТ Р МЭК 86-1.
П6.8.2 аа) 4) Это требование дано аналогично требованию для ИМПЛАНТИРУЕМЫХ ИМПУЛЬСНЫХ ГЕНЕРАТОРОВ.
П6.8.2 аа) 5) Имплантируемый ПРОВОД-ЭЛЕКТРОД или ПРОВОД-ЭЛЕКТРОД с КАБЕЛЕМ ПАЦИЕНТА образуют путь к миокарду, который обладает низким сопротивлением для тока. Опасность фибрилляции, возникающая в результате утечки переменного тока, значительно увеличивается в случае соединения сетевого источника питания с системой ПРОВОДОВ-ЭЛЕКТРОДОВ. Особое внимание следует обратить на надлежащее заземление работающего от ПИТАЮЩЕЙ СЕТИ ИЗДЕЛИЯ, которое применяется вблизи ПАЦИЕНТА.
П6.8.2 аа) 6) Источники сильных электрических помех могут временно ухудшить работу ИЗДЕЛИЯ. В присутствии чрезмерного уровня помех ИЗДЕЛИЕ может полностью прекратить стимуляцию или перейти на асинхронную стимуляцию.
П6.8.2 аа) 7), 8) Необходимо чтобы ПАЦИЕНТ был защищен от случайных электрических импульсов, которые могут попасть на ПАЦИЕНТА через контакты зажимов КАБЕЛЯ ПАЦИЕНТА НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА и находящихся внутри ПАЦИЕНТА ПРОВОДОВ-ЭЛЕКТРОДОВ. Правильное обращение с ИЗДЕЛИЕМ уменьшит возможность случайного поражения электрическим током при проведении клинических процедур с использованием соединений различных временных ПРОВОДОВ-ЭЛЕКТРОДОВ и постоянных ПРОВОДОВ-ЭЛЕКТРОДОВ с КАБЕЛЕМ ПАЦИЕНТА или непосредственно с НЕИМПЛАНТИРУЕМЫМ ИМПУЛЬСНЫМ ГЕНЕРАТОРОМ.
П6.8.2 аа) 9) Существует большое разнообразие съемных батарей, особенно щелочных, на напряжение 9 В (по нормативным документам). Использование батарей с химическими характеристиками, отличными от рекомендуемых изготовителем, может привести к:
1) очень короткому сроку службы после включения индикатора разряда батареи;
2) ухудшению рабочих характеристик НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА и/или
3) общему сокращению срока службы батареи.
Существуют требования на механические характеристики батарей на напряжение 9 В, которые могут быть различными по размерам и конфигурации выводов. Применение батарей, не рекомендуемых изготовителем, может привести к неправильной стимуляции или прекращению стимуляции.
П6.8.2 аа) 10) Предсказание рабочих характеристик, особенно срока службы после срабатывания индикатора разряда батареи, зависит от знания характеристик работы батареи. Батареи с различными физическими размерами могут привести к плохому контакту или перемежающемуся контакту.
П6.8.2 аа) 11) Неблагоприятные условия, непосредственно возникающие перед применением ИЗДЕЛИЯ, могут отрицательно воздействовать на надежность ИЗДЕЛИЯ.
П6.8.2 аа) 12) Поскольку надежная работа НАРУЖНОГО КАРДИОСТИМУЛЯТОРА связана, главным образом, с безопасностью ПАЦИЕНТА, требования, относящиеся к обслуживанию, являются важными.
П7 Требования пункта относятся к ИЗДЕЛИЯМ, присоединяемым к сетевому источнику питания, что не применимо к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ, рассматриваемым в настоящем частном стандарте. Для ИЗДЕЛИЙ, на которые распространяется настоящий частный стандарт, перезаряжаемая батарея должна быть полностью отсоединена от ИЗДЕЛИЯ для ее перезарядки.
П14.1 Ссылка на ИЗДЕЛИЯ КЛАССА I изъята, так как ИЗДЕЛИЯ, рассматриваемые в настоящем частном стандарте, могут получать энергию только от ВНУТРЕННЕГО ИСТОЧНИКА ПИТАНИЯ, само ИЗДЕЛИЕ не может быть присоединено к ПИТАЮЩЕЙ СЕТИ.
П14.2 См. подпункт 14.1.
П14.4 См. подпункт 14.1.
П14.5 ИЗДЕЛИЕ классифицируется как ИЗДЕЛИЕ с ВНУТРЕННИМ ИСТОЧНИКОМ ПИТАНИЯ только в том случае, если ВНУТРЕННИЙ ИСТОЧНИК ЭЛЕКТРОПИТАНИЯ не имеет внешних соединений, или если электрическое соединение с ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ (например, в случае с перезаряжаемой батареей) может быть выполнено только после физического и электрического отделения ВНУТРЕННЕГО ИСТОЧНИКА ЭЛЕКТРОПИТАНИЯ и зарядного устройства, если такое имеется, от остальной части ИЗДЕЛИЯ. ИЗДЕЛИЕ, не отвечающее этому требованию, классифицируется как ИЗДЕЛИЕ КЛАССА I или КЛАССА II с ВНУТРЕННИМ ИСТОЧНИКОМ ЭЛЕКТРОПИТАНИЯ.
П19.1 b) При наличии емкостной связи между РАБОЧЕЙ ЧАСТЬЮ и другими частями неизбежно присутствие некоторого количества ТОКА УТЕЧКИ. Во время стимулирующего импульса ТОКИ УТЕЧКИ могут быть больше, чем из-за емкостной связи, но намного меньше, чем предполагаемый ток стимулирующего импульса, и они не будут представлять опасности для ПАЦИЕНТА и ПОЛЬЗОВАТЕЛЯ.
П19.3 а) Постоянный ток между электродами в теле больного может привести к повреждению в тканях и в электродах. Предусматривается требование, согласно которому ни в одном из проводящих путей ток утечки не должен превышать 0,1 мкА (см. ГОСТ Р 51073). Поскольку НЕИМПЛАНТИРУЕМЫЕ ИМПУЛЬСНЫЕ ГЕНЕРАТОРЫ используются в течение относительно коротких периодов времени, то могут допускаться более высокие уровни ДОПОЛНИТЕЛЬНЫХ ТОКОВ В ЦЕПИ ПАЦИЕНТА как в НОРМАЛЬНЫХ УСЛОВИЯХ (1 мкА), так и в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ (5 мкА).
П19.4 j) 4) НЕИМПЛАНТИРУЕМЫЙ ИМПУЛЬСНЫЙ ГЕНЕРАТОР может иметь импульс разряда, площадь которого (интеграл амплитуды по времени) равна площади стимулирующего импульса и имеет противоположную полярность. Цель разрядного импульса состоит в том, чтобы ток, проходящий через ткани и ПРОВОД-ЭЛЕКТРОД, был нулевым. Так как импульс "разряда" следует сразу за импульсом стимуляции, измерение ДОПОЛНИТЕЛЬНОГО ТОКА В ЦЕПИ ПАЦИЕНТА (постоянный ток смещения) проводят непосредственно перед импульсом стимуляции, чтобы импульс "разряда" не был включен в измерение.
П36 НАРУЖНЫЕ КАРДИОСТИМУЛЯТОРЫ используются в условиях, в которых не принимают специальных мер предосторожности для уменьшения вероятности и величины статических разрядов (то есть, не применяют в помещениях, где регулируется влажность, где не используются антистатические покрытия и т.д.). В этих условиях вероятнее всего, что НАРУЖНЫЕ КАРДИОСТИМУЛЯТОРЫ могут подвергнуться статическим разрядам, которые могут повредить незащищенное устройство. Уровень жесткости 4 выбирают как максимальный испытательный уровень, так как на практике электростатическое напряжение 15 кВ может возникнуть, и ОПЕРАТОР может подвергнуться воздействию такого разряда (см. ГОСТ 29191).
Выбирается метод воздушного разряда, потому что ПОЛЬЗОВАТЕЛЬ, подходя к ИЗДЕЛИЮ по кафельному полу или по ковру, может через воздушный зазор попасть под разряд.
В соответствии с ГОСТ 29191 необходимо использовать по крайней мере 10 единичных разрядов. Это число увеличивается в зависимости от сложности ИЗДЕЛИЯ. При более высоких уровнях напряжения число разрядов уменьшается до двух для уменьшения возможной ошибки из-за условий испытаний, так как вероятность появления более высоких напряжений меньше, чем вероятность появления более низких напряжений. При уровнях жесткости 3 и 4 временное ухудшение характеристик, требующих вмешательства ОПЕРАТОРА или возврата системы, разрешаются. Остальные требования, связанные с электромагнитной совместимостью, являются предметом рассмотрения специальных стандартов на электромагнитную совместимость.
П44.2 Это требование распространяется на устройства, составной частью которых является ванна или камера для хранения жидкости, что не относится к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ, на которые распространяется настоящий частный стандарт.
П44.3 Это требование относится к устройствам, требующим применения жидкостей в НОРМАЛЬНЫХ УСЛОВИЯХ ЭКСПЛУАТАЦИИ, что не применимо к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ, на которые распространяется настоящий частный стандарт.
П44.4 Это требование относится к устройствам, в которых жидкость может просочиться в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ, что не применимо к НАРУЖНЫМ КАРДИОСТИМУЛЯТОРАМ, на которые распространяется настоящий частный стандарт.
П44.6 Есть вероятность использования ИЗДЕЛИЯ поблизости от жидкостей, которые могут быть непреднамеренно расплесканы на устройство в рабочем состоянии, например еда, питье, моча, внутривенные растворы и т.д. Возможно также, что ИЗДЕЛИЕ будет вынесено и использовано вне медицинского помещения. Поэтому необходимо иметь некоторую защиту от проникания жидкости и попадания дождя.
Соляной раствор концентрации 9 г/л был выбран как наименее благоприятный раствор, моделирующий жидкость, содержащуюся в организме. Были выбраны 400 мл для моделирования наполненного большого стакана или кофейной чашки. Вытирание насухо ИЗДЕЛИЯ после наличия на нем жидкости в течение 30 с будет нормальной реакцией на расплескивание. ИЗДЕЛИЕ должно продолжать нормально работать во время расплескивания и после него.
Если раствор проникает в электронный блок, то могут возникнуть нежелательные пути утечки тока. Поэтому выбираются 24 ч между моментом воздействия и осмотром.
Надежность защиты от проникания жидкостей оценивается двумя способами:
1) получением уверенности, что работоспособность устройства не ухудшилась во время расплескивания (нежелательные пути утечки тока образуют участки нежелательного замыкания цепи);
2) визуальный проверкой отсутствия жидкости, пятен или следов от ручейка в электронике, после того как раствор просочился после некоторого времени в электронный блок и растекся там.
П49.101 Это требование считается важным с точки зрения избежания последствий неожиданной разрядки батарей.
П50.2 аа) Точности измерения параметров, приведенных в таблице 103, основаны на данных, которые приняты для имплантируемых кардиостимуляторов (см. ГОСТ Р 51073). Цель методов испытаний - сделать возможной общую оценку функционирования НЕИМПЛАНТИРУЕМОГО ИМПУЛЬСНОГО ГЕНЕРАТОРА без специального измерительного оборудования.
Соответствие параметров следует проверять измерением во время испытания с полностью заряженными батареями, работающими при температуре 20 °С. Температуру (20±2) °С выбирают потому, что:
1) это типичная окружающая температура в медицинских помещениях с регулируемыми параметрами;
2) это температура, при которой характеристики разряда первичной батареи определяются в соответствии с нормативными документами.
Чтобы испытать устойчивость параметров при различных установленных частотах, значения 60 и 120 импульсов в минуту выбирают как типичные.
П50.2 bb) Опыт показал, что диапазон от 200 до 1000 Ом представляет собой диапазон значений импеданса электрода, включая ткани сердца, который можно ожидать в ходе временной стимуляции. Типичным значением является 500 Ом. Колебания, связанные с изменением нагрузки, должны быть измерены при фиксированной частоте стимуляции. Частота 70 импульсов в минуту выбрана в качестве общераспространенной частоты, доступной для всех устройств.
П51.101 а) Может возникнуть необходимость дефибрилляции ПАЦИЕНТА, соединенного с НАРУЖНЫМ КАРДИОСТИМУЛЯТОРОМ. Поскольку может не хватить времени для отключения ИЗДЕЛИЯ, а его работа потребуется после дефибрилляции, важно чтобы импульсы дефибрилляции не повредили ИЗДЕЛИЕ.
Методы испытаний и измерения для проверки соответствия являются теми же, что и для имплантируемых кардиостимуляторов.
П51.102 Неправильная настройка органов управления может явиться результатом случайности; поэтому должны быть приняты меры для снижения такой возможности.
П51.103 Допуски, приведенные в перечислении 3) ЭКСПЛУАТАЦИОННЫХ ДОКУМЕНТОВ, предназначены для того, чтобы расширить срок службы источника питания от полностью заряженной батареи до времени, когда сядет батарея. Если действие ИЗДЕЛИЯ меняется, или если ИЗДЕЛИЕ не способно поддерживать свои характеристики с теми допусками, которые приведены в перечислении 3), то в перечислении 4) описываются новые характеристики ИЗДЕЛИЯ, и оно испытывается по той же методике испытаний, которая используется для проверки электрических параметров по перечислению 3).
П51.104 а) Эта способность ИЗДЕЛИЯ требуется для предупреждения возникновения неожиданной, опасно высокой, частоты стимуляции в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ.
П51.104 b) Высокие частоты стимуляции полезны в условиях выполнения тщательного мониторинга ПАЦИЕНТА при условии, что под рукой имеется дефибрилляционная аппаратура. Должны быть приняты чрезвычайные меры предосторожности, чтобы избежать случайной высокочастотной стимуляции и чтобы непреднамеренно не оставить ИЗДЕЛИЕ с отключенной защитой от выхода частоты за допустимые пределы.
П51.105 ИЗДЕЛИЕ во время НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ может оказаться в помещении, где присутствуют мощные продолжительные электрические поля. Для максимальной безопасности в этих случаях ИЗДЕЛИЕ должно возвращаться в стандартный режим после прекращения помех.
П51.106 Если ИЗДЕЛИЕ располагает ПОСЛЕДОВАТЕЛЬНЫМИ А-V-РЕЖИМАМИ С ДЕТЕКТИРОВАНИЕМ АКТИВНОСТИ И СТИМУЛЯЦИЕЙ В ОБЕИХ КАМЕРАХ, то должны быть предусмотрены средства для установления предела слежения за внутренней активностью предсердия до уровня ритма, который не будет наводить аритмию в желудочке. Это значение не зависит от частоты, выходящей за пределы верхнего допуска, установление которой имеет целью предупредить чрезмерно высокую частоту в УСЛОВИЯХ ЕДИНИЧНОГО НАРУШЕНИЯ.
П56.3 аа) Защита разъема, обеспечивающая невозможность прикосновения к зажимам, до тех пор пока КАБЕЛЬ ПАЦИЕНТА соединен с НЕИМЛАНТИРУЕМЫМ ИМПУЛЬСНЫМ ГЕНЕРАТОРОМ, уменьшает потенциальную возможность создания источника ТОКА УТЕЧКИ. Если зажимы обнажены, они могут оказаться в контакте с каким-либо источником ТОКА УТЕЧКИ во время нормального использования НАРУЖНОГО КАРДИОСТИМУЛЯТОРА ПОЛЬЗОВАТЕЛЕМ или ПАЦИЕНТОМ. Случайный контакт с возможным источником ТОКА УТЕЧКИ, такой как больничная кровать или что-либо другое, может произойти, если НАРУЖНЫЙ КАРДИОСТИМУЛЯТОР упал или его уронили.
П56.101 Индикатор выхода обеспечивает быструю индикацию работы устройства. Однако цепь, которая выполняет дополнительно мониторинг фактического выходного пульса, не может сразу определить, приводит ли данная операция к возбуждению сердца. Определение надлежащей работы ИЗДЕЛИЯ и распространение импульса на сердце требует экспертного изучения электрокардиограммы.
П56.102 Индикатор входа обеспечивает индикацию того, что устройство детектирует электрическую активность сердца и реагирует на сигнал, который указан изготовителем для выбранного режима стимуляции и других рабочих характеристик устройства.
ПРИЛОЖЕНИЕ ММ (справочное). Дополнительные требования к наружным кардиостимуляторам с внутренним источником питания
ПРИЛОЖЕНИЕ ММ
(справочное)
В настоящем приложении дана таблица применения пунктов технических требований и методов испытаний настоящего стандарта в зависимости от стадий жизненного цикла изделий и вида испытаний
Таблица ММ.1
Номер пункта настоящего стандарта | |||||
Разработка изделия | Предварительные испытания | Приемочные испытания | Квалификационные испытания | Приемосдаточные испытания | Периодические испытания |
1-6, 10, 13- | 4, 6, 7, 10 | 4, 6, 7, 10, | 4, 6, 7, 10, | 6, 7, 19, 20, | 10, 14, 15, |
21, 23, 36, | 15-21,23, | 14-21, 23, | 15-21, 23, | 23, 46, 51, | 17, 18, 42, |
42, 43, 44, | 36, 42, 43, | 36, 42, 44, | 42, 44, 46, | 56 | 49, 50, 56 |
46, 49, 50, | 44, 46, | 46, 49, 50, | 49, 50, 56 | ||
51, 52, 54, | 49-52, 54, | 51 | |||
56 | 56 | ||||
__________________________________________________________________________
УДК 616.12:658.382.3:006.354 ОКС 11.040.60 Р07 ОКСТУ 9444
Ключевые слова: изделие медицинское электрическое, безопасность, испытание, наружный кардиостимулятор, импульсный генератор
__________________________________________________________________________